-
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水溶解;再加入足量氢氧化钠溶液(微热),产生白色沉淀并有气泡冒出。
②取少量样品加入足量稀盐酸有气泡产生,振荡后固体完全溶解。
该白色粉末可能为
A. NaHCO3、MgCl2 B. NH4HCO3、AlCl3
C. (NH4)2 CO3、BaCl2 D. NH4 HCO3、MgCl2
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A. 泡沫灭火器利用硫酸铝和小苏打溶液反应的产物来灭火
B. 为使水果尽快成熟,可用浸泡过高锰酸钾溶液的硅土吸收水果产生的乙烯
C. 煤的干馏、燃煤烟气的脱硫、煤的液化和气化等过程都是化学变化
D. 面粉生产中禁止添加的过氧化钙(CaO2)阴、阳离子的个数之比为1:1
难度: 简单查看答案及解析
-
设NA表示阿伏伽德罗常数的值,下列判断正确的是
A. 常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数均为0.3NA
B. 标准状况下,22.4L NO和11.2 L O2充分反应,产物的分子数为NA
C. 60g SiO2晶体中,含Si-O键数为2NA
D. 向含有0.2mol NH4Al(SO4)2的溶液中滴加NaOH 溶液至沉淀恰好完全溶解,消耗OH-的数目为NA
难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是
A. 鉴别己烷、己烯和乙醇,可用溴水
B. 乙烯和植物油均能使溴的四氯化碳溶液褪色,且反应原理相同
C. 甲苯苯环上的一个氢原子被-C3H6Cl取代,形成的同分异构体有9种
D. 1mol分子式为C18H26O5的酯完全水解生成lmol 羧酸和2mol乙醇,该羧酸分子式为C14H18O5
难度: 中等查看答案及解析
-
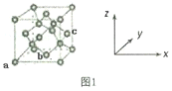
A、B、C、D、E、F均为短周期主族元素,它们的原子序数依次增大,其中A的阴离子的核外电子数与B、C、D 原子的核外内层电子数相同。B的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产D的单质,E的原子序数为D的两倍。根据以上叙述,下列说法中正确的是
A. 上述六种元素的原子半径大小为A
B. A、B、D三种元素可形成既含极性共价键又含非极性共价键的化合物
C. A、B、C、F原子的核外最外层电子数的总和为18
D. 由A与B组成的化合物的沸点一定低于由A与D组成的化合物的沸点
难度: 中等查看答案及解析
-
海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是
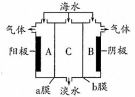
A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
难度: 简单查看答案及解析
-
常温下,将一定浓度的HA和HB分别与0.10mol/L的NaOH溶液等体积混合,实验记录如下表:
实验编号
加入的酸
加入酸的浓度/(mol/L)
混合后溶液的pH
①
HA
0.10
8.7
②
HB
0.12
2
下列说法中正确的是
A. HA是强酸,HB是弱酸
B. 升高温度,溶液②中c(B-)/c(Na+)增大
C. 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH->c(H+)
D. 溶液②中离子浓度的关系:c(Na+)+c(H++c(B-)=0.12 mol/L
难度: 中等查看答案及解析
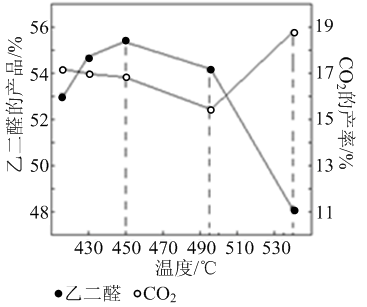
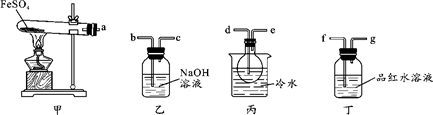
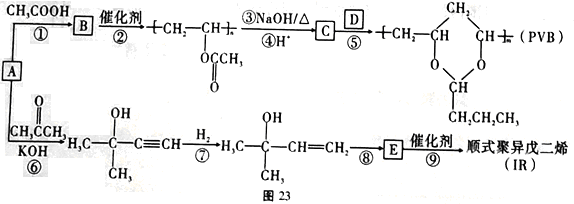
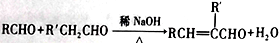 ,(R、R'表示烃基或氢);以A为起始原料,选用必要的无机试剂合成D,写出合成路线_____________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,(R、R'表示烃基或氢);以A为起始原料,选用必要的无机试剂合成D,写出合成路线_____________________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。