-
下列关于有机物的说法正确的是( )
A.乙烯、聚乙烯都能使酸性高锰酸钾溶液褪色
B.戊烷(C5H12)有2种同分异构体
C.苯、乙酸和油脂都可以发生取代反应
D.除去乙酸乙酯中的乙酸,可以用饱和氢氧化钠溶液难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1mol苯乙烯()中含有的碳碳双键数为4NA
B.6.2g氧化钠晶体中含有0.2NA个Na+
C.标准状况下,22.4L空气含有NA个单质分子
D.1mol•L-1NH4Cl溶液中,NH4+的数目小于NA难度: 中等查看答案及解析
-
下图为实验室中完成不同化学实验所选装置或相关操作,其中正确的是( )
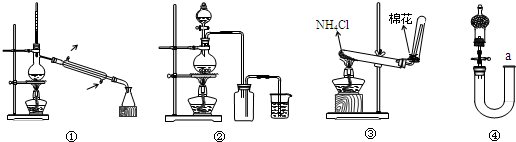
A.装置①常用于分离互不相溶的液体
B.实验室用MnO2和浓盐酸制备Cl2可用装置②
C.实验室可用装置③制备少量NH3
D.用从a处加水的方法检验装置④的气密性难度: 中等查看答案及解析
-
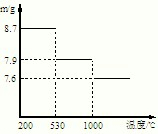
已知:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1现将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示.以下说法不正确的是( )

A.0~1min的平均反应速率大于3~4min的平均反应速率
B.达到平衡时H2的转化率为75%
C.在其它条件不变时,曲线II的条件改变为使用催化剂
D.在其它条件不变时,曲线I的条件改变为升高温度难度: 中等查看答案及解析
-
下列各组物质按如图所示转化关系每一步都能一步实现的是( )
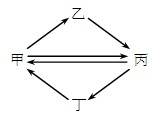
A.甲FeCl3乙FeCl2丙Fe2O3丁Fe(OH)3
B.甲Cu乙CuO丙CuSO4丁CuCl2
C.甲NO乙HNO3丙NO2丁NH3
D.甲Si乙Na2SiO3丙SiO2丁H2SiO3难度: 中等查看答案及解析
-
常温下,0.1mol•L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-6,下列叙述正确的是( )
A.该溶液中c(A-)+c(HA)+c(H+)=0.1mol•L-1
B.该溶液中水电离产生的c(H+)=1×10-4mol•L-1
C.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
D.该溶液与0.05mol•L-1NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)难度: 中等查看答案及解析
-
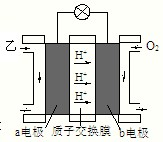
如图是一种可充电的锂离子电池充放电的工作示意图.放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)
下列有关说法正确的是( )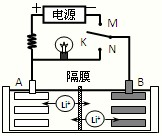
A.该电池的总反应式为Li1-xMnO2+LixC6LiMnO2+C6
B.K与M相接时,A是阳极,发生氧化反应
C.K与N相接时,Li+由A极区迁移到B极区
D.在整个充、放电过程中只存在3种形式的能量转化难度: 中等查看答案及解析