-
下列叙述正确的是( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
C.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.干冰、液态氯化氢都是电解质
B.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
C.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
D.Na2O2晶体中既含有离子键又含有共价键
难度: 中等查看答案及解析
-
下列操作不能达到目的的是( )
选项
目的
操作
A
配制100 mL1.0 mol·L-1CuSO4溶液
将25 g CuSO4·5H2O溶于100 mL蒸馏水中
B
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C
在溶液中将MnO4—完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
难度: 简单查看答案及解析
-
下列各项表达中正确的是
A.Na2O2的电子式为

B.106的乙醇和丙醇混合液完全燃烧生成的CO2为112L (标准状况)
C.在氮原子中,质子数为7而中子数不一定为7
D.Cl-的结构示意图为

难度: 简单查看答案及解析
-
下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42 - =BaS04↓+2H2O
B.酸性介质中KMnO4氧化 H2O2:2MnO4- +5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O
C.等物质的量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4 + 2H2O-2e- = PbO2+4H++SO42 -
难度: 简单查看答案及解析
-
通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )

A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
难度: 困难查看答案及解析
-
下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )
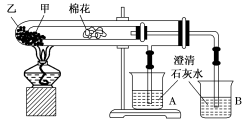
A.甲为小苏打,乙为纯碱
B.要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.加热不久就能看到A烧杯的澄清石灰水变浑浊
D.整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
难度: 困难查看答案及解析
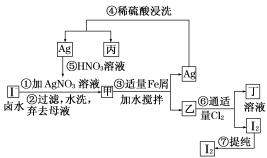

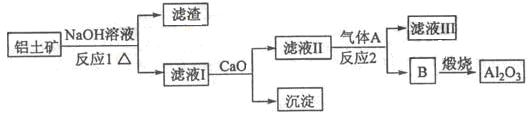
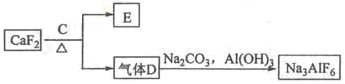
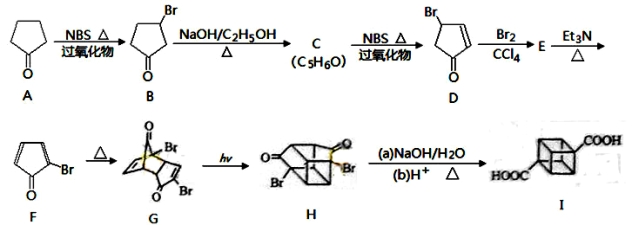
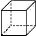 )具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
)具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线: