-
下列说法正确的是 ( )
①离子化合物含离子键,也可能含极性键或非极性键 ②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤熔融状态能导电的化合物是离子化合物 ⑥由分子组成的物质中一定存在共价键
A. ①③⑤ B. ②④⑥ C. ①②③⑤ D. ①③⑤⑥
难度: 中等查看答案及解析
-
下列化学式只表示一种纯净物的是:
A. C2H4Cl2 B. C4H10 C. C2H6 D. C3H7CI
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
A. NH4Br的电子式:
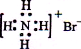
B. S2-的结构示意图:
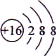
C. 比例模型
 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子D. 丙烷的结构简式为:CH3CHCH3
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 食物因氧化而腐败是放热反应 B. 人体运动所消耗的能量与化学反应无关
C. 生物质能源是解决农村能源主要途径 D. 使用沼气作能源可以保护森林
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 1molCnH2n+2中有3nNA 对共用电子 B. 在18gD2O中含有10NA个质子
C. 1molCH2Cl2在标准状况下约为22.4L D. 1molNa2O2中阴阳离子个数比为1:2
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A.
与
得电子能力相同
B. 核外电子排布相同的微粒化学性质也相同
C. Cl-、S2-、Ca2+、K+半径逐渐减小
D. 同主族元素含氧酸的酸性随核电荷数的增加而减弱
难度: 中等查看答案及解析
-
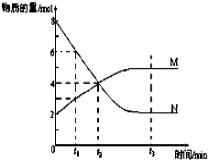
将1mol纯净的A置于特制的真空密闭容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其分解达到平衡:A(s)
2B(g)+C(g)下列可以判断该反应己经达到化学平衡状态的是
A. 反应速率:vB(正)=vC(逆) B. 气体的总体积保持不变
C. B的体积分数不变 D. 混合气体的密度保持不变
难度: 困难查看答案及解析
-
X、Y、Z、W为原子序数依次增大的同周期的短周期元素.已知X、Z、W三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水.下列判断正确的是( )
A. X、Z、W三种元素的最高价氧化物对应的水化物有两种是强碱、一种是强酸或两种是强酸、一种是强碱
B. X、Z、W三种元素有两种是金属、一种是非金属
C. W元素在第三周期第ⅥA族
D. X、Y、Z三种元素的单质熔沸点依次降低
难度: 困难查看答案及解析
-
假如R元素无同位素,元素R原子的质量数为A,Rm-的核外电子数为X,则W gRm-所含中子的物质的量为( )
A. (A-X+m) mol B. (A-X-m) mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
根据下表部分短周期元素信息,判断以下叙述正确的是( )
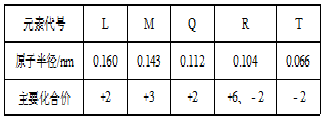
A. 氢化物的沸点为H2T<H2R B. 单质与稀盐酸反应的剧烈程度L<Q
C. M与T形成的化合物具有两性 D. L2+与R2﹣的核外电子数相等
难度: 中等查看答案及解析
-
下列有关电池的叙述正确的是( )
A. 手机上用的锂电池属于一次电池
B. 锌锰干电池中,为了延长电池寿命,可将NH4Cl换成KOH
C. 甲烷燃料电池工作时甲烷在负极被还原
D. 太阳能电池的主要材料为二氧化硅
难度: 中等查看答案及解析
-
已知
号元素的离子
、bX+、
、
都具有相同的电子层结构,下列关系正确的是( )
A. 质子数:
B. 氢化物的稳定性:
C. 离子的还原性:
D. 原子半径:
难度: 困难查看答案及解析
-
已知正四面体形分子
与线型分子
反应,生成四面体形分子
和直线型分子
。组成
分子中的元素的原子序数都小于10,组成
分子的元素为第三周期的元素。如下图,则下列判断中正确的是( )
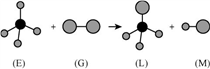
A. 常温常压下,
是一种液态有机物 B.
是一种含有非极性键的分子
C. 干燥的
能漂白有色物质 D. 上述反应的类型是取代反应
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(s)
2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·s-1
难度: 中等查看答案及解析
-
科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
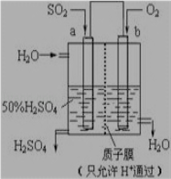
A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
难度: 中等查看答案及解析
-
将4 moI A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应
2Ag+Bg
2Cg, 若经2s后测得C的浓度为06 mo1·L1,现有下列几种说法:
① 用物质A表示的反应的平均速率为03 mol·L1·s 1
② 用物质B表示的反应的平均速率为06 mol·L1·s 1
③ 2s时物质A的转化率为70%
④ 2s时物质B的浓度为07 mo1·L1
其中正确的是 ( )A ①③ B ①④ C ②③ D ③④
难度: 简单查看答案及解析
-
下列各组物质中,不论两种物质以何种比例混合,只要总质量一定,经完全燃烧后,产生的CO2质量不变的是( )
A. 乙烯和苯 B. 乙醇和乙酸 C. 甲醛(HCHO)和葡萄糖 D. 丙烯和丙烷
难度: 中等查看答案及解析
-
在120℃、101kPa下,a mL由氢气、乙烯组成的混合气体在b mL氧气中充分燃烧后,恢复到原温度和压强。已知b > 3a,且燃烧后气体体积缩小了b/16mL,则乙烯的体积为( )
A.b/16mL B.b/8mL C.(a- b/8) mL D.(a+ b/8) mL
难度: 中等查看答案及解析
-
利用下列反应不能制得括号中纯净物的是( )
A.等物质的量的氯气与乙烷在光照条件下反应(氯乙烷)
B.乙烯与水加成(乙醇)
C.乙烯与氯气加成(1,2二氯乙烷)
D.液溴与苯用溴化铁作催化剂反应(溴苯)
难度: 中等查看答案及解析
-
轴烯是一类独特的星形环烃.三元轴烯(
)与苯( )
A.均为芳香烃 B.互为同素异形体
C.互为同系物 D.互为同分异构体
难度: 中等查看答案及解析