-
FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3 在空气中易潮解,加热易升华。请回答下列问题:

(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
| ②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
-
亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠(NaClO2),请根据下面的工艺流程图回答下列问题:
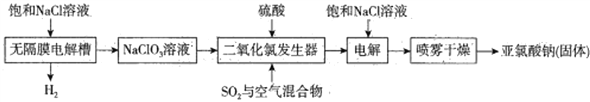
已知:纯的ClO2易分解爆炸。一般用稀有气体或空气稀释到10%以下安全。
(1)电解饱和NaCl溶液之前须除去其中的Ca2+、Mg2+、SO42-等杂质,依次加入BaCl2溶液、Na2CO3溶液、NaOH溶液,充分反应后将沉淀一并滤去,若经检测发现滤液中SO42-的浓度仍大于10-5mol·L -1,其可能的原因为____________________,滤液中c(CO32-)∶c(SO42-)为____________。[已知:Ksp(BaSO4 )= 1.0×10 -10,Ksp(BaCO3 )= 5.0×10-9 ]
(2)无隔膜电解槽内发生的反应中氧化产物、还原产物的物质的量之比为____________。
(3)将制得的ClO2 通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,通电一段时间后可得到产品,电解时阴极的电极反应式为_____________________________。
(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,反应的离子方程式为______________。
(5)ClO2溶液的浓度含量可用碘量法测定,其原理为在盐酸介质中ClO2与I-发生反应:2ClO2+8H++10I-=2Cl-+5I2+4H2O,再用Na2S2O3标准液滴定生成的I2,通过计算即可确定ClO2溶液浓度含量。已知:I2+2Na2S2O3=2NaI+Na2S4O6。
①滴定过程中需要滴加的指示剂为____________。
②取V1 mL的ClO2溶液加入到适量的盐酸和KI溶液中,反应完毕后再用0.lmol·L-1 的Na2S2O3溶液滴定反应后的溶液,若消耗了V2mL的Na2S2O3溶液,则ClO2 的浓度为____________ g·L-1。(杂质不参与反应,ClO2 的还原产物为Cl- )
-
苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯: (g)
(g)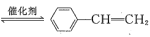 (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
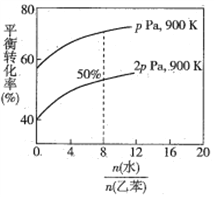
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛:  (g) + 2O2→
(g) + 2O2→ + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
-
H、C、N、O、F、Se 是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________种,基态硒原子的价层电子排布式为________,N元素第一电离能大于O元素第一电离能的原因为____________。
(2)某高效低毒的新型农药的结构简式为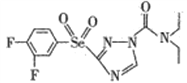 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________ (填“ 能”或“不能” )形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________ (填“ 能”或“不能” )形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________,SeO2 的空间构型为________,与SeO3 互为等电子体的分子和离子为________。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。
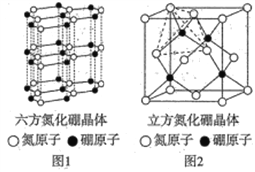
①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm -3,则阿伏加德罗常数的值为________。
-
2017年四川九寨沟“8.8”地震导致多人脑损伤,L为治疗脑损伤的药物,合成L的线路如下:
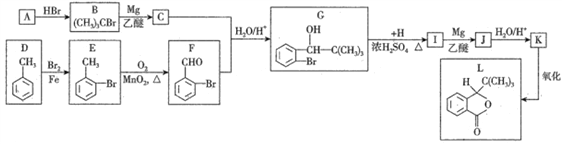
已知:①F能发生银镜反应;
②R-Br+Mg RMgBr(格氏试剂),格氏试剂能与羰基发生反应,如:R'-CHO+RMgBr→
RMgBr(格氏试剂),格氏试剂能与羰基发生反应,如:R'-CHO+RMgBr→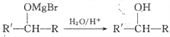 + Mg(OH)Br。
+ Mg(OH)Br。
请回答下列问题:
(1)烃A的化学名称为________________。
(2)C+F→G发生反应的类型依次为_________、_________。
(3)H 的结构简式是_____________,L的分子式为______________。
(4)D→E 的化学反应方程式为_________________________________。
(5)1mol I(酯类有机物)与足量NaOH反应,消耗NaOH的物质的量为_________ mol。
(6)X 为G的同分异构体,满足下列条件:
①遇FeCl3溶液显紫色②有两个甲基直接连在苯环上③苯环上的一氯代物只有1种其中核磁共振氢谱为4组峰的X的结构简式为_________、_________。
随溶液pH变化的关系如图所示,下列说法正确的是( )
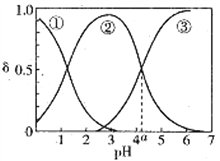
的比值先增大后减小


 (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
 ,则该物质中氮原子的杂化轨道类型为________,其分子之间________ (填“ 能”或“不能” )形成氢键。
,则该物质中氮原子的杂化轨道类型为________,其分子之间________ (填“ 能”或“不能” )形成氢键。

 + Mg(OH)Br。
+ Mg(OH)Br。