-
化学与生产、生活密切相关。下列叙述不正确的是
A. 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体
B. 煤的干馏和石油的分馏均属化学变化
C.
可用于文物年代的鉴定,
与
互为同位素
D. 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
难度: 中等查看答案及解析
-
下列解释事实的离子方程式不正确的是
A. 铝片放入NaOH溶液中有气体产生:2Al + 2OH-+ 2H2O===2AlO2-+3H2↑
B. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深: Cr2O72-(橙色) + H2O
2CrO42-(黄色) + 2H+
C. 向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32-+ CO2 + H2O === H2SiO3(胶体)+ CO32-
D. 用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4 + CO32-
CaCO3 + SO42-
难度: 困难查看答案及解析
-
具有下列组成和结构特点的有机化合物中同分异构体数目最多的是(不考虑立体异构)
选项
A
B
C
D
分子式
C4H8Cl2
C5H10O2
C4H8O2
C8H10
类别
含氯化合物
羧酸
酯
含有苯环的烃
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
“化学实验→观察现象→分析推理→得出结论”是化学学习的方法之一。下列说法正确的是
A. 证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉KI试纸检验,观察试纸颜色变化
B. 验证淀粉的水解产物是否具有还原性,取酸性水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
C. 向铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色褪去,该过程中发生的反应为2Al+3Ag2S===6Ag+Al2S3
D. 将SO2通入足量稀Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2∶3
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 元素X与M形成的原子比为1:1的化合物只有一种
C. XZ2、X2M2、W2Z2均为直线型的共价化合物
D. 由X、Y、Z、M四种元素形成的化合物可能含有离子键
难度: 中等查看答案及解析
-
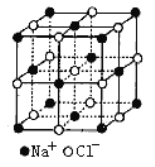
我国科研人员研制出一种室温“可呼吸” NaCO2电池。该电池放电时“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如右图所示。吸入的全部CO2中,有
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是
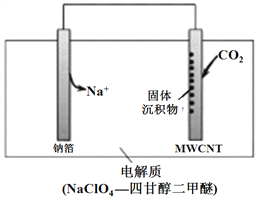
A. “吸入”CO2时,钠箔为正极
B. “吸入”CO2时的正极反应为4Na++3CO2+4e-===2Na2CO3+C
C. “呼出”CO2时,Na+向多壁碳纳米管电极移动
D. 标准状况下,每“呼出” 22.4 L CO2,转移电子的物质的量为0.75 mol
难度: 困难查看答案及解析
-
常温下,向浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg
随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度与体积的变化)。下列叙述正确的是
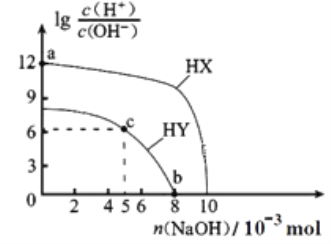
A. a点由水电离出的c(H+)=10-12 mol·L-1
B. b点时酸碱恰好完全中和
C. c点溶液中:c(Y-)>c(HY)
D. HX、HY均为弱酸且酸性HX>HY
难度: 困难查看答案及解析
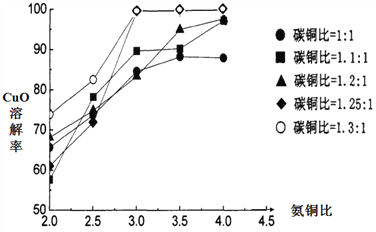
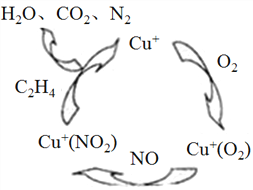
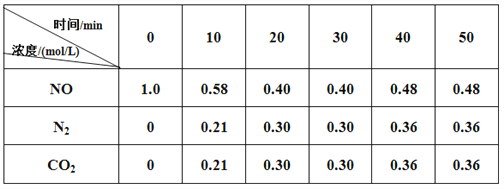
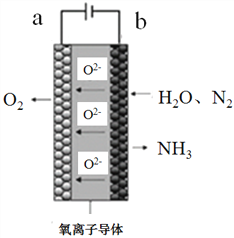
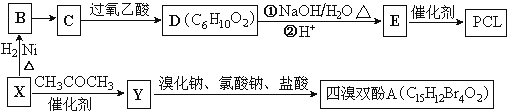
 ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料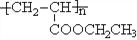 ,,写出合成该涂料的反应流程图:______________________________________________。
,,写出合成该涂料的反应流程图:______________________________________________。