-
化学与生活、生产密切相关,下列有关说法正确的是( )
A. 某同学的体检报告单显示其血液中葡萄糖含量为4.94mmol/L,mmol/L是物质的量的单位
B. 石油是复杂的混合物,通过分馏可以获得汽油、煤油等,通过催化重整可以获得乙烯、丙烯等
C. 自然界中的方铅矿(PbS),遇上CuSO4溶液会慢慢变成铜蓝(CuS)说明Ksp(PbS)> Ksp(CuS)
D. 水玻璃是制备木材防火剂的原料,其主要成分是二氧化硅
难度: 中等查看答案及解析
-
CH2=CH-COOCH3是重要的有机合成中间体,可以通过下列反应合成
CH2=CH-COOH+CH3OH
CH2=CH-COOCH3+H2O
下列说法错误的是( )
A. 该有机合成反应属于取代反应
B. CH2=CH-COOCH3分子中处于同一平面的原子最少有3个
C. CH2=CH-COOH没有官能团相同的同分异构体
D. CH2=CH-COOCH3可以发生加成、氧化、取代反应
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是( )
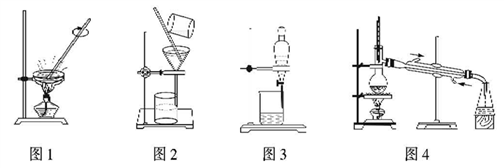
A. 用图1所示装置蒸发FeCl3溶液制得无水FeCl3
B. 用图2所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
C. 用图3所示装置从CH3OH与C2H5OH的混合物中分离出乙醇
D. 用图4所示装置从CH3COOH与CH3COOC2H5的混合物中分离出乙酸乙酯
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示。R与X能形成X2R、X2R2化合物,Z是地壳中含量最多的金属元素,T原子最外层电子数是K层电子数的2倍。下列推断正确的是( )

A. X和Y组成的化合物的水溶液保存在塑料瓶中 B. 原子半径和离子半径均满足:Y<Z
C. 最高价氧化物对应的水化物酸性:Z>T D. 含Z元素的盐溶液一定显酸性
难度: 困难查看答案及解析
-
某充电电池如图所示,已知a、b为惰性电极,溶液呈酸性,充电时左槽溶液颜色由蓝色变为黄色。下列叙述正确的是( )
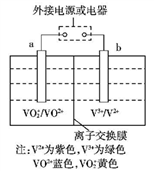
A. 放电时,a极是电池的负极 B. 充电时,a极的电极反应式为:VO2++2H++e-=VO2++H2O
C. 氧化性VO2+>V3+ D. 放电时,H+从左槽迁移进右槽
难度: 困难查看答案及解析
-
向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )
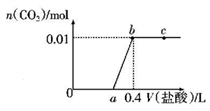
A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
难度: 困难查看答案及解析
-
下列实验中关于物质检验的结论错误的是( )
实验步骤
现象
结论
A
取待测液,滴加酸性高锰酸钾溶液
酸性高锰酸钾溶液褪色
待测液中可能存在Fe2+
B
将待测气体通入品红溶液中, 稍后加热溶液
开始品红溶液褪色,加热后又变为红色
待测气体中肯定含SO2
C
取待测液,滴加硝酸酸化的 BaCl2溶液
生成白色沉淀
待测液中可能含Ag+
D
将湿润的KI淀粉试纸较长时 间置于待测气体中
取出后没有观察到试纸变色
待测气体中肯定不含Cl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
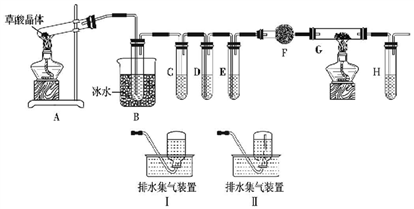
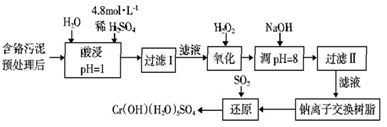
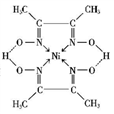
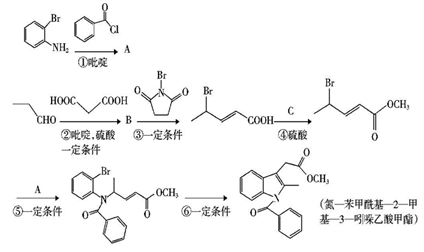
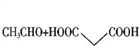
 CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O