-
东晋医药学家葛洪的《肘后备急方·治寒热诸疟方》 记载有“青蒿一握,以水二升渍,绞取汁,尽服之”的说法,说明不能加热青蒿,因高温可能使活性成分受损。中国药学家屠呦呦用沸点只有35℃的乙醚作为溶剂来提取青蒿素,创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.已知青蒿素的结构如图所示,下列有关青蒿素的说法,不正确的是
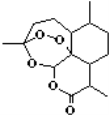
A.分子式为C15H23O5
B.能够发生水解反应
C.用沸点只有35℃的乙醚作为溶剂来提取青蒿素的方法化学上叫萃取
D.青蒿素能够治疗疟疾可能与结构中存在过氧键或酯基等基团有关
难度: 简单查看答案及解析
-
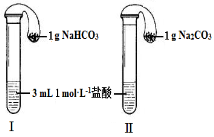
设NA为阿伏加德罗常数,则下列叙述正确的是
A.标准状况下,2.24LCCl4中含有0.4NA个碳氯单键
B.22.4LCl2通入水中充分反应,共转移NA个电子
C.1 L 1 mol/L的氯化铜溶液中Cu2+的数目小于NA
D.5.6g铁在0.1 mol氯气中充分燃烧,转移的电子数为0.3NA
难度: 简单查看答案及解析
-
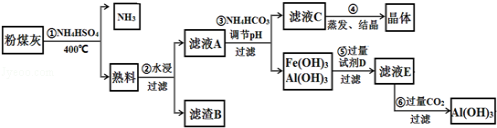
下列有关物质检验的实验结论正确的是
选项
实 验 操 作 及 现 象
实 验 结 论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
将某气体通入品红溶液中,品红溶液褪色
该气体一
定是SO2
D
将稀硫酸滴加到某溶液,产生的气体可使澄清石灰水变浑浊
该溶液中一定含有HCO3-
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
B.在无色透明的溶液中:K+、Cu2+、SO42-、NO3-
C.含有0.1 mol·L-1 Ca2+溶液在中:Na+、K+、CO32-、Cl-
D.室温下,pH=1的溶液中: Na+、Fe3+、NO3-、SO42-
难度: 简单查看答案及解析
-
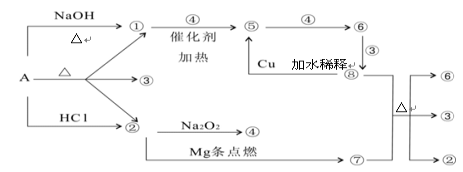
利用光伏并网发电装置电解尿素[CO(NH2)2]的碱性溶
液制氢的装置示意图(电解池中隔膜仅阻止气体
通过,阴、阳极均为惰性电极, CO(NH2)2 中的氮元素显-3价)。

下列叙述中正确的是
A
.工作时,A极的电极上CO(NH2)2 放电生成N2 反应为还原反应
B.工作时,B极的电极反应式
为2H2O+ 2e-===2OH-+H2↑
C. N型半导体为正极,P型半导体为负极
D.制氢装置溶液中电子流向:从B极流向A极
难度: 困难查看答案及解析
-
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是
A.原子半径:Y<Q<W
B.ZX3可使紫色石蕊溶液变蓝
C.X、Z、Q 3种元素可组成离子化合物或共价化合物
D.X2Q2、Y2X6 2种分子中含有的电子总数、化学键种类都相同
难度: 中等查看答案及解析
-
常温下,下列有关电解质溶液的叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.pH=2的盐酸与pH=12的氨水等体积混合后所得溶液pH=7
C.pH之和为14的CH3COOH溶液和NaOH溶液混合后溶液的显酸性则a一定大于b
D.将10mLpH=a的盐酸与100 mLpH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13
难度: 困难查看答案及解析