-
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
A.与铜质水龙头连接处的钢质水管易发生腐蚀
B.明矾常作为净水剂,双氧水通常可用于作杀菌消毒
C.食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜
D.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器灭火
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质④不锈钢和目前流通的硬币都是合金⑤硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑥豆浆和雾都是胶体。上述说法正确的是
A.①②④⑤ B.①⑤⑥ C.①③④⑥ D.②③④⑤
难度: 中等查看答案及解析
-
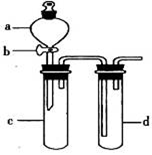
下列仪器名称正确或规范的是

难度: 简单查看答案及解析
-
将等物质的量的镁和铝混合均匀,再将混合物均分为四份,分别加入足量的下列溶液,充分反应后,放出氢气最多的是
A.8mol/L NaOH溶液 B.2mol/L HNO3溶液
C.3mol/L HC1溶液 D.18mol/LH2SO4溶液
难度: 中等查看答案及解析
-
下列操作会导致实验结果偏高的是
A.中和热测定实验中,用铜制环形搅拌器代替环形玻璃搅拌棒,所测中和热的数值
B.中和滴定测定盐酸溶液浓度,量取20.00mL待测盐酸溶液的滴定管未用待测盐酸溶液润洗
C.用托盘天平称量10.5g某物质,砝码和药品的位置放反,所称药品的质量
D.配制一定物质的量浓度溶液时,用量筒量取浓溶液的体积时仰视读数,所配溶液的浓度
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示)

下列有关说法正确的是
A.第①步中除去粗盐中的
、
、
、
等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaC12溶液→过滤后加盐酸
B.第②步中结晶出的MgC12
6H2O可在空气中受热分解制无水MgC12
C.从第③步到第⑤步的目的是浓缩
D.在第③④⑤步中溴元素均被氧化
难度: 中等查看答案及解析
-
下表是元素周期表的一部分,有关说法不正确的是
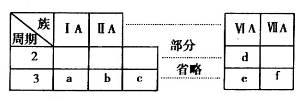
A.元素e的氧化物对应的水化物均为强酸
B.a、b、d、e四种元素的离子半径:
C.b、f两种元素形成的化合物为离子化合物
D.a、c、e的最高价氧化物对应的水化物之间能够相互反应
难度: 中等查看答案及解析
-
某溶液可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种①在该溶液中加入足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色的溶液中加入BaC12溶液时无沉淀生成;③向淀粉溶液中滴加该橙黄色溶液未变蓝色,则在该溶液中肯定存在的离子组是
A.Na+、SO32-、I- B.Na+、Br-、CO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、Br-
难度: 中等查看答案及解析
-
学生甲和学生乙完成了下列实验,其中实验现象完全相同的是
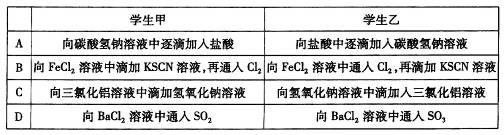
难度: 中等查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①淀粉、油脂、蛋白质在一定条件下都能发生水解反应
②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物
③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液
④石油的分馏和煤的气化都是发生了化学变化
⑤淀粉遇碘酒变蓝色,在加热条件下葡萄糖能与新制Cu(OH)2悬浊液发生反应
⑥除去CH4中的少量C2H4:通过盛有溴水的洗气瓶
A.①②⑤⑥ B.①②④⑤ C.①③⑤⑥ D.③④⑤⑥
难度: 中等查看答案及解析
-
某同学按右图所示的装置进行实验,A、B为两种常见金属,它们的硫酸盐可溶于水。当K闭合时,在交换膜处
从右向左移动。下列分析正确的是
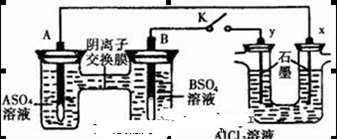
A.B的电极反应:
B.溶液中A2+浓度减小
C.y电极上有H2产生,发生还原反应
D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是
A.80mL 10mol
浓盐酸与足量MnO2反应,转移电子数为0.4NA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA
C.1 mol A13+含有核外电子数为3NA
D.常温下,16g CH4中共用电子对的数目为4NA
难度: 中等查看答案及解析
-
下列推断正确的是
A.CO、NO、NO2都是大气污染的气体,在空气中都能稳定存在
B.Na2O、Na2O2组成元素相同,两化合物中阴阳离子个数比也相同
C.SiO2是酸性氧化物,只能与碱反应而不能与酸反应
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红
难度: 中等查看答案及解析
-
下列说法不正确的是
A.将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B.0.1mol
的NaHCO3溶液中
C.0.1mol
的NaHA溶液Ph=5,则溶液:
D.pH=4的醋酸与pH=10的氢氧化钠溶液等体积混合,所得溶液
难度: 中等查看答案及解析
-
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O,据此判断X元素的最高化合价为
A.+7 B.+6 C.+5 D.+1
难度: 中等查看答案及解析
-
某恒温密闭容器发生可逆反应
,在
时刻反应达到平衡,在
时刻缩小容器体积,
时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是

A.Z和W在该条件下至少有一个是为气态
B.
时间段与
时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则
时间段与
时刻后的X浓度不相等
D.若该反应只在某温度
以上自发进行,则该反应的平衡常K随温度升高而增大
难度: 中等查看答案及解析