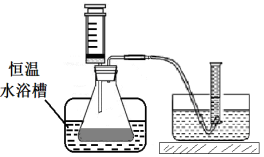
-
化学与生活密切相关,下列生活中的常见物质按酸碱性的一定顺序依次排列正确的是
A.厕所清洁剂、醋、肥皂、厨房清洁剂
B.厕所清洁剂、厨房清洁剂、醋、肥皂
C.醋、厕所清洁剂、肥皂、厨房清洁剂
D.厨房清洁剂、醋、肥皂、厕所清洁剂
难度: 中等查看答案及解析
-
下列说法不正确的是
A
.能够发生有效碰撞的分子叫做活化分子,活化分子所多出的那部分能量称作活化能。
B.对于某一反应aA + bB =cC + dD,△H单位中的mol-1是指每摩尔(aA + bB =cC + dD)反应。
C.研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学。
D.甲烷分子具有正四面体结构的原因是碳原子的2s轨道与2p轨道发生sp杂化。
难度: 中等查看答案及解析
-
汽车尾气中的有害物质NO和CO能缓慢起反应,2CO + 2NO
N2 + 2CO2,为了控制大气污染,某同学提出了下列建议,你认为可行的方法是
A.改变汽车尾气排放压强
B.提高反应温度
C.在尾气排放处使用催化剂
D.向汽车发动机燃烧室中通入过量的空气
难度: 简单查看答案及解析
-
常温下,柠檬水溶液的pH是4,苹果醋溶液的pH是5,则柠檬水溶液与苹果醋溶液的c(OH-)之比为( )
A.10:1 B.1:10 C.2:1 D.4:5
难度: 中等查看答案及解析
-
在密闭容器中,加入一定量的A、B混合气体,发生反应:xA(g) + yB(g)
zC(g),平衡时测得A的浓度为0.80mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.40mol/L,下列有关判断正确的是
A.x + y < z
B.平衡向正反应方向移动
C.B的转化率降低
D.C的产率不变
难度: 中等查看答案及解析
-
下列各组关于强电解质、弱电解质、不是电解质的归类,完全正确的是
A
B
C
D
强电解质
Fe
NaCl
CaCO3
HNO3
弱电解质
CH3COOH
NH3
H3PO4
Fe(OH)3
不是电解质
C12H22O11(蔗糖)
BaSO4
C2H5OH
H2O
难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂一定不是
A.NH3·H2O B.MgO C.MgCO3 D.Mg(OH)2
难度: 简单查看答案及解析
-
以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是
A.具有吸附性
B.溶解度大于CuS、PbS、CdS
C.溶解度小于CuS、PbS、CdS
D.MnO2的氧化性强于Cu2+、Pb2+、Cd2+等金属离子
难度: 困难查看答案及解析
-
下列关于铜电极的叙述中不正确的是
A.用电解法精炼粗铜时,粗铜作阳极
B.在原电池中,铜电极只能作正极
C.在镀件上镀铜时,金属铜作阳极
D.锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应
难度: 中等查看答案及解析
-
下列事实不能用平衡移动原理解释的是
A.Mg(OH)2不溶于水,但能溶于浓NH4Cl溶液中
B.水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸除去
C.洗涤BaSO4沉淀时,用稀硫酸洗涤BaSO4沉淀比用蒸馏水洗涤损失少
D.FeCl3溶液中混有FeCl2,常加入少量的H2O2,使Fe2+氧化为Fe3+
难度: 简单查看答案及解析
-
下列有机物的系统命名错误的是
A.2-甲基-2,4-己二烯 B.4-甲基-1-戊炔
C.2-甲基-6-乙基庚烷 D.1,3,5-三甲苯
难度: 简单查看答案及解析
-
烷烃C5H12的所有同分异构体,与氯气发生取代反应生成一氯代物的种数最多为(不考虑空间异构)
A.6 B.7 C.8 D.9
难度: 困难查看答案及解析
-
下列有关说法错误的是
A.邻二甲苯属于芳香烃,它的官能团是
B.分子结构
 是维生素A的键线式
是维生素A的键线式C.氯溴碘代甲烷的同分异构体数目有两个,就像人的左右手似的。
D.乙醇与二甲醚互为同分异构体,这种同分异构现象叫官能团异构。
难度: 中等查看答案及解析
-
密闭容器中,反应2X(g)+Y(g)
2Z(g) △H= Q kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的体积分数(φ)与反应时间(t)的关系如图所示。下列判断正确的是
A.T1 < T2 , P1 < P2 ,Q > 0
B.T1 > T2 , P1 > P2 ,Q > 0
C.T1 > T2 , P1 > P2 ,Q < 0
D.T1 < T2 , P1 < P2 ,Q < 0
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4 、(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+) >c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中: c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+) >c(X-)>c(H+)>(OH-)
难度: 中等查看答案及解析
-
用已知浓度盐酸滴定未知浓度的NaOH溶液,以酚酞作指示剂,下列操作会使所测NaOH溶液浓度偏低的是
A.锥形瓶洗净后还留有蒸馏水
B.取碱液的滴定管开始有气泡,放出液体后气泡消失
C.溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液无变化
D.用碱式滴定管取一定体积的NaOH溶液时,量取前仰视读数,量取后俯视读数
难度: 中等查看答案及解析