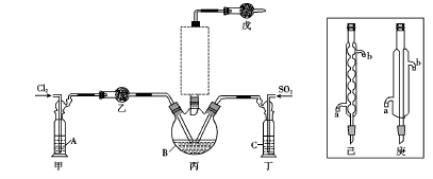
-
下列有关说法不正确的是( )
A.沿海城市建筑时直接从海洋里取用海沙,可以大大降低成本
B.“地沟油”禁止使用,但处理后可以制生物柴油和肥皂
C.乙醇溶液、双氧水均可用于杀菌消毒,但原理不同
D.维生素C和铁粉是常用的抗氧化剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4 L二氯甲烷中共价键数目为4NA
B.1mol Na2O2与足量的CO2和H2O(g)的混合物反应,转移的电子数为NA
C.足量MnO2与含4 mol HCl的浓盐酸反应生成的Cl2分子数为NA
D.1.0 L0.1mol/L的NaAlO2溶液中含有的氧原子数为0.2NA
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期元素,X的M电子层有1个电子,Y的最外层电子数为内层电子数的2倍,Z的最高化合价为最低化合价绝对值的3倍,Z与W同周期,W的原子半径小于Z,下列叙述正确的是( )
A.四种元素中,Z元素的非金属性最强
B.只有X、Y、Z存在两种或两种以上的氧化物
C.只有X与其他元素生成的化合物都是离子化合物
D.Y、Z、W分别与氢形成的化合物中化学键均为极性共价键
难度: 中等查看答案及解析
-
下列各组物质同分异构体(不含立体异构)不正确的是( )
A.分子式为C5H10的烯烃共有5种
B.分子式为C5H10O2的酯共有10种
C.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有4种
D.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有8种
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是( )
选项
操作
现象
解释或结论
A
测定等浓度的Na2CO3和Na2SO3溶液的pH
Na2CO3溶液的pH较大
非金属性C<S
B
向盛有2ml0.1mol/L AgNO3溶液的试管中滴加一定量0.1mol/L NaCl溶液,再向其中滴加一定量0. 1mol/L KI溶液,
先有白色沉淀生成,后又产生黄色沉淀
Ksp(AgCl)> Ksp(AgI)
C
室温下,取相同大小、形状和质量的Cu粒分别投入0.1mol/L的稀硝酸和10.0mol/L的浓硝酸中
Cu粒与浓硝酸反应比与稀硝酸反应剧烈
探究浓度对化学反应速率的影响
D
用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合溶液
阴极上先析出铜
金属活动性:Mg>Cu
难度: 中等查看答案及解析
-
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼( N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述正确的是( )
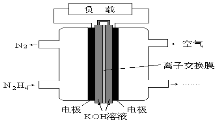
A.电子从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4 - 4e-=N2+4H+
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时.K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
难度: 中等查看答案及解析
-
下列坐标图均涉及平衡原理,其中相关表述正确的是( )

A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
B.图②表示2SO2(g)+O2(g)
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
C.图③表示反应2NH3(g)
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D.图④表示AgCl(s)
Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
难度: 困难查看答案及解析