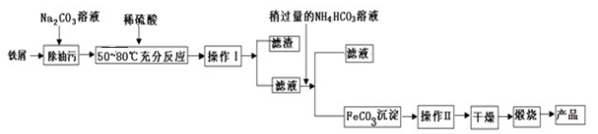
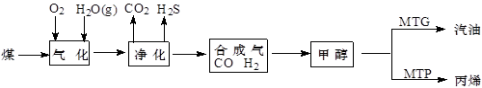-
化学在生产和生活中有重要的应用。下列说法正确的是
A.次氯酸钠是漂粉精的主要成分
B.氧化钠可用于呼吸面具
C.凡含有添加剂的食物对人体健康均有害,不宜食用
D.“开发利用新能源”、“汽车尾气催化净化”都能提高空气质量
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
实验操作
实验目的
A
将SO2通入酸性KMnO4溶液中
证明SO2具有漂白性
B
用pH试纸测定NaHS溶液的pH
比较HS- 电离程度和水解程度的相对大小
C
向含有FeCl3杂质的NH4Cl溶液中加入氨水使pH值在7~8之间
除去杂质FeCl3
D
向含酚酞的Na2CO3溶液中加入CaC12溶液
证明Na2CO3溶液中存在水解平衡
难度: 中等查看答案及解析
-
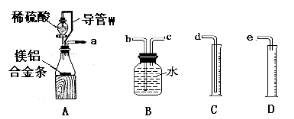
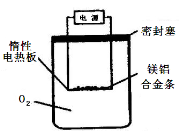
下列装置或操作能达到实验目的的是

难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.向FeI2溶液中通入等物质的量的Cl2: 2I-+Cl2=2Cl-+I2
B.用过量氨水吸收烟道气中的SO2: SO2+NH3•H2O===HSO3-+NH4+
C.向NaHSO4溶液中加入Ba(OH)2至中性: H++SO42-+Ba2++OH-=H2O+BaSO4↓
D.向AgCl饱和溶液中滴加Na2S溶液: 2AgCl+S2-=Ag2S+2Cl-
难度: 困难查看答案及解析
-
某有机物分子中含有一个C6H5— 、一个—C6H4— 、一个—CH2— 、一个—OH,则该有机物属于酚类(—OH直接连在苯环上的物质属于酚类)的结构可能有
A.2 种 B.3 种 C.4 种 D.5 种
难度: 困难查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表所示:
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5.+3.-3
-2
下列叙述正确的是
A.X.Y元素的金属性:X<Y
B.Z的最高价含氧酸分子式为H3ZO4
C.Y的最高价氧化物对应的水化物能溶于氢氧化钠溶液
D.Z的氢化物比W的氢化物稳定
难度: 中等查看答案及解析
-
有关下列两种溶液的说法中,不正确的是
①0.2 mo1·L-1 CH3COONa溶液 ②0.1 mo1·L-1H2SO4溶液
A.相同温度下,溶液中水的电离程度:①>②
B.向①加水后所得溶液c(CH3COO-)/c(CH3COOH)的比值变大
C.等体积混合溶液①和溶液②,所得溶液中2c(SO42-) = c(Na+)
D.25℃时,向溶液②中滴加溶液①至pH = 7,溶液中c(Na+) >c(CH3COO-) + c(SO42-)
难度: 困难查看答案及解析