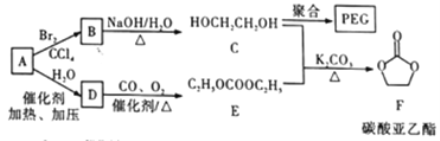
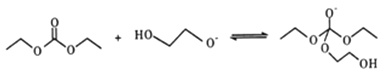
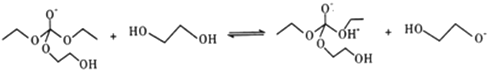
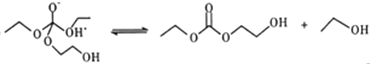
-
化学与生活、 生产、 环境密切相关。 下列说法不正确的是
A. 卤水点豆腐、明矾净水的原理都是破坏胶体的介稳性
B. 使用含有氯化钙的融雪剂会加速桥梁的腐蚀
C. “山东疫苗案”涉及疫苗未冷藏储运而失效, 这与蛋白质变性有关
D. 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐
难度: 简单查看答案及解析
-
化学在古代与现代的科技发展中起了十分重要的作用,下列说法中正确的是
A
B
C
D




古代与现代的冶金均运用了相同的化学原理
古代与现代的火箭发射均利用了液体燃料
古代捣碎中药与现代中药纳米粉碎均是化学变化
古代风筝与现代热气球飞行均无需物质直接供给能量
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某无色溶液中含有NH4+、K+、Al3+、SO42ˉ四种离子,进行如下实验:
(1)取10 mL该溶液于试管中并滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03 mol白色沉淀;
(2)取10 mL该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体(必要时可加热),最后沉淀完全溶解。并且随NaOH溶液的加入,沉淀和气体的变化关系如下图所示。

下列说法不符合事实的是( )
A. 根据图所示数据计算实验中使用的NaOH溶液的物质的量浓度为1mol/L
B. 根据信息分析该溶液中焰色反应呈现紫色的离子的物质的量浓度为1mol/L
C. 另取一定量该溶液滴加一定量的Ba(OH)2溶液,能使Al3+和SO42ˉ同时完全沉淀
D. NH4+、K+、Al3+、SO42ˉ四种离子的物质的量之比为:2:1:1:3
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.4gMg在空气中完全燃烧,转移电子数一定为0.2NA
B. 标准状况下,2.24L HF中所含原子总数一定为0.2NA
C. 5.6gFe在稀硝酸中完全溶解,转移电子数一定为0.2NA
D. 12.0g熔融的NaHSO4中,阳离子的总数一定为0.2NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、R、W的原子序数依次增大,X的某种原子无中子,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,Z与X同主族,R与Y同主族。下列说法正确的是
A. 热稳定性:X2Y< X2R< XW B. 酸性:XWY4> X2RY4
C. 原子半径由大到小的顺序为:.R、W、Z、Y D. 化合物X2Y2、Z2Y2的化学键类型完全相同
难度: 中等查看答案及解析
-
电解Na2CO3溶液制取NaHCO3溶液和NaOH溶液的装置如下图所示。下列说法中,不正确的是

A. 阴极产生的物质A是H2
B. 溶液中Na+由阳极室向阴极室迁移
C. 物质B是NaCl,其作用是增强溶液导电性
D. 阳极OH- 放电,H+浓度增大,CO32-转化为HCO3-
难度: 中等查看答案及解析
-
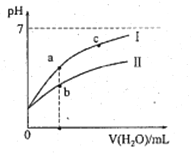
下表为25℃时某些弱酸的电离平衡常数;下边图像表示25℃时,稀释CH3COOH、HClO两种酸的稀溶液,溶液pH随加水量的变化。常温下,有关说法正确的是
弱酸的电离平衡常数(25℃)
CH3COOH
HClO
Ka=1.8×10-5
Ka=3.0×10-8
A. 图像中,a点酸的总浓度>b点酸的总浓度
B. 图像中,c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HClO)
C. pH相同的CH3COONa溶液和NaClO溶液的浓度关系:c(CH3COOHNa)<c(NaClO)
D. 两溶液浓度相等,CH3COONa溶液的c(OH-)+c(CH3COO-)>NaClO溶液的c(OH-)+c(C1O-)
难度: 中等查看答案及解析

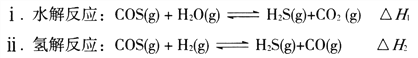
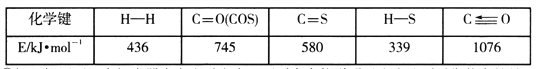

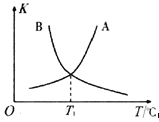
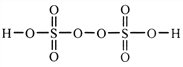
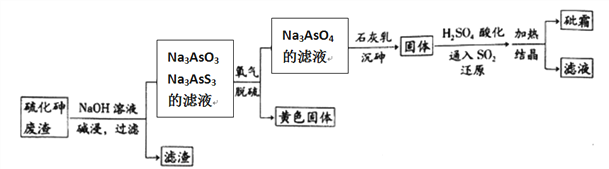
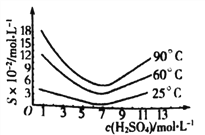
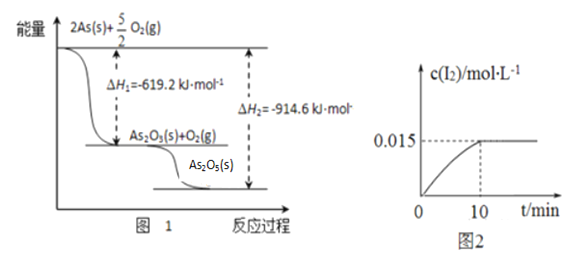
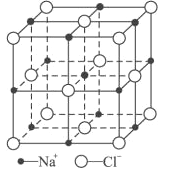 。
。