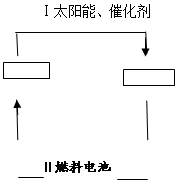
-
下列说法不正确的是
A.吸热反应在一定的条件下也能发生
B.放热的反应在常温下不一定很容易发生
C.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
D.需要加热才能发生的反应一定是吸热反应
难度: 中等查看答案及解析
-
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是
A.质子数:c>b B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
难度: 中等查看答案及解析
-
在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3一定是离子化合物
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y一定属于同一周期
D.X和Y一定不属于同一主族
难度: 简单查看答案及解析
-
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下:
N+
He→
O+
H, 下列叙述正确的是
A.
O原子核内有9个质子 B.
H原子核内有1个中子
C.O2和O3互为同位素 D.通常情况下,He和N2化学性质都很稳定
难度: 中等查看答案及解析
-
下列对化学反应的认识错误的是
A.会引起化学键的变化 B.会产生新的物质
C.必然引起物质状态的变化 D.必然伴随着能量的变化
难度: 中等查看答案及解析
-
下列叙述正确的是
A.离子晶体中一定不含有非极性共价键
B.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
C.冰主要是通过水分子间氢键作用形成的
D.同一元素不可能既表现金属性,又表现非金属性
难度: 中等查看答案及解析
-
N2(g)+3H2(g)==2NH3(g)在体积不变的密闭容器中反应,下列叙述表示处于化学平衡状态的是
A、N2、H2、NH3的浓度比为1:3:2的状态
B、混合气体的密度不随时间而变化
C、当有1molN≡N键断裂时,有6molN-H键断裂
D、单位时间内消耗amolN2的同时,消耗3amol的H2的状态
难度: 中等查看答案及解析
-
关于碱金属的叙述正确的是
A、随核电荷数的增加,碱金属单质与水反应的剧烈程度增大
B、随核电荷数的增加,碱金属单质熔、沸点升高
C、随核电荷数的减小,碱金属原子的还原性增强
D、随核电荷数的减小,碱金属单质的密度增大
难度: 中等查看答案及解析
-
下列装置能构成原电池的是( )

难度: 中等查看答案及解析
-
下列含有非极性共价键的化合物是
A.HI B. Na2O2 C. Br2 D. NaCl
难度: 中等查看答案及解析
-
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是
A.它是一种共价化合物
B.在加热时此化合物不能分解为PH3和HI
C.这种化合物不能跟碱反应
D.该化合物可以由PH3和HI化合而成
难度: 中等查看答案及解析
-
A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.C>B>A D.B>C>A
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.CCl4 D.PCl5
难度: 中等查看答案及解析
-
对于可逆反应2SO2 + O2
2SO3,在混合气中充入一定量的18O原子,达到平衡以后,18O原子
A.只存在于O2中。 B.只存在于O2和SO2中
C.只存在于O2和SO3中 D.存在于O2、SO2和SO3中
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是
A.Ag B.Zn(OH)2 C.Ag20 D.Zn
难度: 中等查看答案及解析
-
下列元素中,原子半径最大的是( )
A.Li B. Na C. F D. Cl
难度: 中等查看答案及解析
-
下列电子式或结构式错误的是

难度: 中等查看答案及解析
-
在密闭容器中进行反应X2(g)+3Y2(g)
2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1mol/L、 0.3mol/L、0.2mol/L,达到平衡时下列物质的浓度可能为
A、X2为0.2mol/L B、Y2为0.2mol/L
C、Z2为0.4mol/L D、Y2为0.6mol/L
难度: 中等查看答案及解析
-
对于反应A+B=C,下列条件的改变一定使化学反应加快的是
A.增加A的物质的量 B.升高体系的温度
C.减少C的物质的量 D.增加体系的压强
难度: 中等查看答案及解析
-
在1L容器中加入4 molA和4 molB发生3A(g)+B(g)
2C(g)的反应,如果A的平均反应速率为0·12mol/(L·s),则10 s时容器中的B是
A、2.8 mol B、1.6 mol C、3.2 mol D、3.6 mol
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应
B.碱金属元素单质越活泼,其熔点和沸点就越高
C.卤族元素单质都能与水剧烈反应
D.卤族元素单质都能和氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强
难度: 中等查看答案及解析
-
可逆反应A(g) +3B(g)
2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是
A、VA=0·15mol/(L·min) B、VB=0·6mol/(L·min)
C、VC=0·4mol/(L·min) D、VD=0·6mol/ (L·min)
难度: 中等查看答案及解析
-
已知原子序数为a的ⅡA族元素X和原子序数为b的ⅢA族元素Y位于元素周期表中同一周期,下列的量值关系不正确的是
A.a=b-1 B.a=b-11 C.b=a+25 D.b=a+30
难度: 中等查看答案及解析
-
一定量的盐酸和过量的铁粉反应时,为了增大反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
A .NaOH(s) B. NaCl(s) C. CuSO4 (s) D. H2O
难度: 中等查看答案及解析
-
将锌片和铜片用导线连接后放入稀硫酸溶液中发生原电池反应,下列叙述正确的是
A.正极附近的SO42- 浓度逐渐增大 B.正极有O2逸出
C.电子通过导线由铜片流向锌片 D.铜片上由H2逸出
难度: 中等查看答案及解析