-
氮化钠和氢化钠与水反应的化学方程式如下:Na3N+3H2O→3NaOH+NH3,NaH+H2O→NaOH+H2↑.有关Na3N和NaH的叙述正确的是( )
A.离子半径:Na+>N3->H+
B.与水反应都是氧化还原反应
C.与盐酸反应都只生成一种盐
D.加热熔化时,都只破坏离子键难度: 中等查看答案及解析
-
下列物质分类正确的是( )
A B C D 酸 HCl气体 硫酸 醋酸 盐酸 碱 熟石灰 烧碱 纯碱 NH3•H2O 盐 小苏打 胆矾 碱式碳酸铜 NaHSO4 氧化物 水 过氧化氢 Al2O3 KClO3 电解质 Cl2 液态HCl NaCl溶液 H2O
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.食品添加剂对人体一定是有害的
B.煤的气化和液化是高效、清洁地利用煤炭的重要途径
C.pH小于7.0的雨水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水污染难度: 中等查看答案及解析
-
下列表示方法正确的是( )
A.H2S分子的比例模型:
B.NH4Cl电子式:
C.苯乙醛结构简式:
D.Cl原子的结构示意图:难度: 中等查看答案及解析
-
黑火药爆炸时的主要反应是:S+2KNO3+3C→K2S+3CO2↑+N2↑,下列说法正确的是( )
A.上述反应的生成物都是无毒的,所以燃放爆竹时不会污染环境
B.该反应的发生需要点燃或撞击,所以它是一个吸热反应
C.硫磺在黑火药爆炸的反应中既是氧化剂,又是还原剂
D.KNO3有强氧化性,乘坐汽车、火车、飞机时不能随身携带难度: 中等查看答案及解析
-
钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H2O+O2+4e→4OH-
B.Fe-2e→Fe2+
C.2H++2e→H2
D.Fe-3e→Fe3+难度: 中等查看答案及解析
-
以下关于纸上层析的叙述,错误的是( )
A.纸上层析法适用于分离和检验化学性质十分相近的分子或离子
B.纸上层析法分为上升纸层析法和径向纸层析法
C.纸上层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑
D.为了看到色斑,只有有色离子的检验才可以用纸上层析法难度: 中等查看答案及解析
-
已知丙氨酸的结构简式为:
 ,则下列说法错误的是( )
,则下列说法错误的是( )
A.丙氨酸属于α-氨基酸
B.丙氨酸是一种两性物质
C.两分子丙氨酸,脱水形成的二肽结构简式为:
D. 可与NaOH溶液共热,放出一种碱性气体
可与NaOH溶液共热,放出一种碱性气体 难度: 中等查看答案及解析
-
下列工业生产的反应原理错误的是( )
A.高炉炼铁:Fe2O3+3CO2Fe+3CO2
B.氨的氧化:4NH3+5O24NO+6H2O
C.煅烧硫铁矿:4FeS2+15O22Fe2O3+8SO3
D.制漂粉精:2Ca(OH)2+2Cl2→CaCl2+Ca(ClO)2+2H2O难度: 中等查看答案及解析
-
茉莉醛具有浓郁的茉莉花香,结构简式如图所示.下列关于茉莉醛的叙述正确的是( )
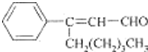
A.茉莉醛与苯甲醛互为同系物
B.茉莉醛分子中最多有10个碳原子位于同一平面
C.茉莉醛能使高锰酸钾溶液、溴水褪色
D.在一定条件下,1mol茉莉醛最多能与4mol氢气加成难度: 中等查看答案及解析
-
设NA为阿佛加德罗常数,下列说法错误的是( )
A.标准状况下,向11.2L NO中通入5.6L O2,所得气体的分子数为0.5NA
B.乙烯和丙烯的混合气体28g,含有的原子数为6NA
C.1L 2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
D.通常状况下,22.4L氢气所含分子数小于NA难度: 中等查看答案及解析
-
向H2S的水溶液中通入一定量的Cl2,下列图象所示的变化正确的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
已知:H+(aq)+OH-(aq)→H2O(l)+57.3kJ.对于下列反应:
①HCl(aq)+NH3•H2O(aq)→NH4Cl(aq)+H2O(l)+a kJ
②HCl(aq)+NaOH(s)→NaCl(aq)+H2O(l)+b kJ
③HNO3(aq)+KOH(aq)→KNO3(aq)+H2O(l)+c kJ
则a、b、c三者的大小关系为( )
A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较难度: 中等查看答案及解析
-
下列实验方案或操作合理的是( )
A.用浓溴水鉴别:苯、CCl4、苯酚溶液、苯乙烯
B.除去NO中混有的少量NO2,可将混合气体通过盛有水的洗气瓶,再用排空气法收集NO
C.在制备乙酸丁酯的实验中,将得到的粗产品先用水洗,再用NaOH溶液洗,然后分液,可得到乙酸丁酯的精品
D.SO42-的检验:加入HNO3酸化的BaCl2溶液,观察是否有白色沉淀生成难度: 中等查看答案及解析
-
T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大X(g)浓度,平衡向正反应方向移动难度: 中等查看答案及解析
-
同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是( )
A.2Na218O2+2H2O→4Na18OH+O2↑
B.2KMnO4+5H218O2+3H2SO4→K2SO4+2MnSO4+518O2↑+8H2O
C.NH4Cl+2H2O⇌NH3•2H2O+HCl
D.K37ClO3+6HCl→K37Cl+3Cl2↑+3H2O难度: 中等查看答案及解析
-
下列说法正确的是( )
A.将100g 10%的盐酸加热蒸发,得到50克溶液,其浓度为20%
B.把3mol/L的硫酸跟等体积的水混合,所得溶液的浓度大于1.5mol/L
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L
D.已知某温度KNO3的溶解度是31.6g/100g水,在该温度下将20g KNO3溶解于50g 水中,所得溶液的质量分数是28.6%难度: 中等查看答案及解析
-
如图所示,向一定量的铁粉中加入一定体积12mol/L的硝酸,加热充分反应后,下列微粒在体系中可能大量存在的是( )
①NO3- ②Fe3+ ③H+ ④Fe2+.
A.有①②
B.有①②③④
C.有①②④
D.有①③④难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:H++SO42-+Ba2++OH-→BaSO4↓+H2O
B.标准状况下将112mL氯气通入10mL1mol/L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2→2Fe3++6Cl-+2Br2
C.用硫化亚铁与稀硝酸反应制H2S气体:FeS+2H+→Fe2++H2S↑
D.向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32-难度: 中等查看答案及解析
-
常温下,现有a mol/L NaX溶液和b mol/L NaY溶液,关于它们的说法错误的是( )
A.若a=b,pH(NaX)>pH(NaY),则相同浓度时HX、HY的酸性:HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY),如果HX是强酸,则HY一定是弱酸
C.若a>b,且上述两溶液呈碱性,c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY)
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1mol/L难度: 中等查看答案及解析
-
如图所示,将Cu(NO3)2•6H2O加热充分反应,关于A物质的说法正确的是( )

A.A物质有挥发性
B.A物质是硝酸铜溶液
C.A物质的质量分数约为58.3%
D.A物质的质量分数约为63.5%难度: 中等查看答案及解析
-
某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种.将X通过适量的氯水时,X恰好完全反应,没有任何气体剩余.将所得的无色溶液分装于两支试管后,分别加入酸化的AgNO3与BaCl2溶液,结果均产生白色沉淀.下列推论正确的是( )
A.X中一定没有CO2
B.X中一定有SO2,产生的沉淀是AgCl与BaSO4
C.X中一定没有HBr
D.X中一定有HCl难度: 中等查看答案及解析

 (也可表示为:
(也可表示为: