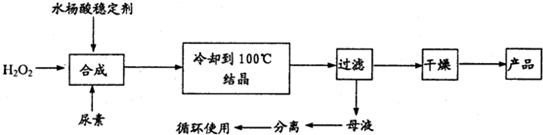
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.25℃时,0.1mol/LpH=4.5的NaHC2O4溶液:c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B.NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.25℃时,pH=9、浓度均为0.1mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+(H+)>c+c(OH-)
D.0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
下列化学用语表示正确的是( )
A.NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑
B.三氟化氮的电子式:
C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-
D.羟基乙酸(HOCH2COOH)的缩聚物:难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.3.6g碳与3.36LO2一定条件下恰好完全反应,生成CO分子数一定为0.3NA
B.6.9g钠与足量的CO2和H2O(g)混合气体充分反应,转移的电子数一定为0.3NA
C.25℃时,0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA
D.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA难度: 中等查看答案及解析
-
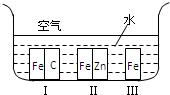
下列装置或操作不能达到实验目的是( )
A.
比较Cl2、Fe3+、I2的氧化性
B.
制取Fe(OH)2
C.
证明铁生锈时空气参加反应
D.
检查装置气密性难度: 中等查看答案及解析
-
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
选项 X Y Z 甲 乙 A H2 Si Cl2 SiCl4 HCl B Mg C O2 CO2 MgO C Zn Fe Cl2 FeCl2 ZnCl2 D O2 N2 H2 NH3 H2O 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
每年3月22日是世界水日,联合国确定的2010年“世界水日”主题是“关注水质、抓住机遇、应对挑战”.下列有关说法或做法不符合这一主题的是( )
A.科学使用农药、化肥,减少水体污染
B.工业废水和城市生活污水需净化处理,坚持达标排放
C.为了节约生产成本,可将造纸厂、化工厂建在水源地上游
D.合理开发水资源,建立水资源节约型和环境友好型经济难度: 中等查看答案及解析
-
在其他条件不变时,改变某一条件对A:(g)+3B(g)═2AB3,(g) 化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度).下列结论正确的是( )
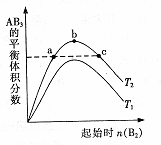
A.a、c两点A2的转化率相等
B.正反应一定是吸热反应,且T2>T1
C.b点时,平衡体系中A、B原子数之比最接近于1:3
D.向a点的平衡体系中加入A2,可达到b点的平衡状态难度: 中等查看答案及解析


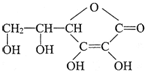 ,它的分子式是______.由于它能防治坏血病,又称为______.在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有______性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______,说明维生素C具有______性.
,它的分子式是______.由于它能防治坏血病,又称为______.在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有______性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是______,说明维生素C具有______性.