-
下列说法正确的是
A.232Th 转换成233U是化学变化,233U和235U的化学性质几乎相同
B.防止自行车钢架生锈主要是利用了电化学防腐原理
C.血液透析是利用了胶体的聚沉性质
D.葡萄酒中含有的微量的二氧化硫具有抗氧化剂作用
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是
A.常温常压下,22.4 L NO2中含有NA个分子
B.1 mol羟基中电子数为10 NA
C.R2+的质量数为A,中子数为N,则n g R该价态的氧化物中含质子数为
D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
难度: 中等查看答案及解析
-
以下关于有机化合物的认识正确的是
A.某烷烃CnH2n+2的一个分子中,含有共价键的数目是3n+1
B.用HNO3酸化的AgNO3溶液检验CCl4中是否含有氯元素
C.红热的铜丝可以和乙醇发生置换反应产生氢气
D.石油化工得到的产品均为液体,煤化工得到的产品有液体也有固体
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表,下列说法正确的是
元素代号
X
Y
Z
M
R
Q
原子半径(×10—10m)
1.86
0.99
1.43
1.60
0.75
0.74
主要化合价
最高正价
+1
+7
+3
+2
+5
——
最低负价
——
—1
——
——
—3
—2
A.X、Z、R的最高价氧化物的水化物之间可两两相互反应
B.元素X和Q形成的化合物中不可能含有共价键
C.X、Z、M的单质分别与水反应,M最剧烈
D.Y的氢化物的水溶液可用于雕刻玻璃
难度: 中等查看答案及解析
-
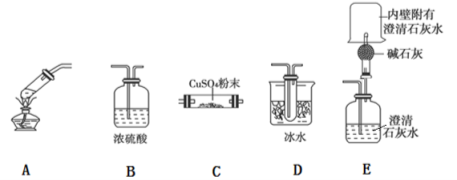
下列说法正确的是

A.用如图装置除去乙烷中混有的乙烯
B.配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大
C.制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
D.玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
难度: 困难查看答案及解析
-
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
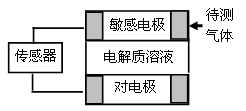
待测气体
部分电极反应产物
NO2
NO
Cl2
HCl
CO
CO2
H2S
H2SO4
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应式为Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2 H2O+ 4e- = 4 OH-
D.检测H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
难度: 困难查看答案及解析
-
水的电离平衡曲线如图所示,下列说法不正确的是

A.图中五点Kw间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,在温度不变时向水中加入适量NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合后,溶液显中性
难度: 困难查看答案及解析