-
江苏省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A.迅速提升我省的家用汽车保有量
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
难度: 中等查看答案及解析
-
下列物质中,不属于高分子化合物的是
A.纤维素 B.蛋白质 C.油脂 D.塑料
难度: 简单查看答案及解析
-
很多化学物质名称中含有“水”,“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示物质处于液态。下列物质名称中的“水”不属于以上三种含义的是
A.水晶 B.水银 C.溴水 D.重水
难度: 简单查看答案及解析
-
公安部发布法令:从2011年5月1日起,醉酒驾驶机动车将一律入刑。下列关于酒精的叙述错误的是
A.化学名称为乙醇 B.易挥发 C.常用作有机溶剂 D.不能燃烧
难度: 简单查看答案及解析
-
科研人员最近发现放射性同位素钬
可有效地治疗肝癌。该同位素原子核内中子数与质子数之差为
A.32 B. 99 C.166 D.233
难度: 简单查看答案及解析
-
下列化学用语或模型表示正确的是
A.Cl-离子的结构示意图:
B.CH4分子的比例模型:
C.CCl4的电子式:
D.氮气的结构式:N=N
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,71 g Cl2含有2 NA个Cl原子
B.把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol·L-1
C.物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+
D.常温常压下,11.2 L N2中含有的分子数为0.5 NA
难度: 中等查看答案及解析
-
下列溶液中的Cl-浓度与100 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液 B.75 mL 0.5mol·L-1CaCl2溶液
C.150 mL 2 mol·L-1 KCl溶液 D.75 mL 1 mol·L-1AlCl3溶液
难度: 中等查看答案及解析
-
在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、CO32-
难度: 中等查看答案及解析
-
在冷的浓HNO3中,下列金属易发生钝化作用的是
A.铜 B.镁 C.锌 D.铝
难度: 简单查看答案及解析
-
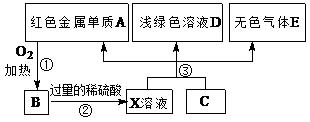
下表各组物质中,物质之间通过一步反应就能实现如下图所示转化的是
物质
选项 a b c d
A Al Al(OH)3 NaAlO2 NaOH
B N2 NO NO2 O2
C Na2CO3 NaHCO3 NaOH CO2
D Cl2 FeCl3 FeCl2 Fe
难度: 困难查看答案及解析
-
下列有关金属或合金的说法中不正确的是
A.生铁属于合金
B.金属的冶炼过程通常是把金属阳离子还原成单质的过程
C.回收废旧金属既可以治理污染,又可以缓解资源短缺
D.工业上电解氧化镁获得金属镁
难度: 简单查看答案及解析
-
将钠、镁、铝各0.3 mol分别放入 足量盐酸中,同温同压下产生气体的体积比是
A.1∶2∶3 B.6∶3∶2
C.3∶1∶1 D.1∶1∶1
难度: 中等查看答案及解析
-
区分碳酸钠和碳酸氢钠固体的方法中(相同条件下),错误的是
A.加热,观察是否有气体放出 B.滴加稀盐酸,比较产生气体的快慢
C.溶于水后加氧化钙,看有无沉淀 D.加热后称量,看质量是否变化
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.铜加入稀硝酸中:3Cu + 8H++ 2NO3-= 3Cu2++ 2NO↑+ 4H2O
B.铁粉溶于稀盐酸中:2Fe + 6H+= 2Fe3+ + 3H2↑
C.碳酸钙和盐酸反应:CO32-+ 2H+= CO2↑+ H2O
D.实验室用浓盐酸与MnO2制Cl2:MnO2 + 2H+ +2Cl-
Cl2↑ + Mn2+ +H2O
难度: 困难查看答案及解析
-
下列反应中是吸热反应的是
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
难度: 简单查看答案及解析
-
下列四支试管中,过氧化氢分解的化学反应速率最大的是
试管 温度 过氧化氢浓度 催化剂
A 室温(25℃) 12% 有
B 水浴加热(50℃) 4% 无
C 水浴加热( 50℃) 12% 有
D 室温(25℃) 4% 无
难度: 简单查看答案及解析
-
铜锌原电池的装置如下图所示,下列叙述不正确的是
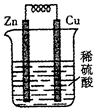
A.溶液中的H+定向移动到正极
B.铜片逐渐溶解,质量减轻
C.锌片为负极
D.该装置可以将化学能转化为电能
难度: 简单查看答案及解析
-
下列实验现象中,由于发生取代反应而引起的是
A.乙烯通入溴的四氯化碳溶液中,溶液褪色
B.甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着
C.苯滴加到溴水中,振荡后水层接近无色
D.将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生
难度: 中等查看答案及解析
-
对于铝热反应:Fe2O3 + 2Al
2Fe + Al2O3,下列说法中正确的是
A.Fe元素的化合价升高
B.若27 g Al参加反应则有3 mol电子转移
C.Fe2O3发生氧化反应
D.Al被还原
难度: 中等查看答案及解析
-
实验是化学研究的基础。下列对实验现象的描述错误的是
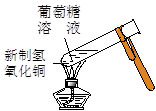
①
②
③
④
A.实验①中溶液变黄色 B.实验②试管中混合溶液变血红色
C.实验③中烧瓶内溶液变红色 D.实验④中出现砖红色沉淀
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,在元素周期表中它们的相对位置如图,已知3种元素的原子序数之和为31,下列有关叙述中正确的是
A.Y元素为Al
B.Z的氧化物不能与强碱溶液反应
C.原子半径大小为Y>Z>X
D.X只能形成一种氧化物
难度: 困难查看答案及解析
-
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3 + Cu =2FeCl2 + CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:
(1)取100 mL废液加入足量的AgNO3溶液,生成沉淀 86.1g。
(2)另取100 mL废液放入铜片充分反应,铜片质量减少了2.56 g。
下列关于原废液组成的判断错误的是
A.c(Fe2+)︰c(Fe3+)︰c(Cu2+) = 2︰1 ︰1
B.c(Fe2+)︰c(Cu2+) = 2︰1
C.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ
D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L
难度: 困难查看答案及解析