-
下列有关实验安全问题的叙述中正确的是( )
A. 少量的浓硫酸沾到皮肤上时,先用大量的水冲洗,再涂上硼酸溶液。
B. 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志
C. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
D. 如果汽油、煤油等可燃物着火,应立即用水扑灭
难度: 简单查看答案及解析
-
包装标签上印有如图警示标记的可能是下列哪种物质 ( )
A. 浓硫酸 B. 高锰酸钾 C. 乙醇 D. 氰化钾
难度: 简单查看答案及解析
-
下列实验操作中正确的是 ( )
A. 蒸发结晶操作时,不会用到玻璃棒。
B. 蒸馏操作时,应使温度计水银球浸没在所蒸馏的液体混合物中。
C. 用CCl4萃取I2水中的I2时,所提取的物质应从分液漏斗下口放出
D. 粗盐提纯的过程中,可依次向粗盐的溶液中加入过量的Na2CO3溶液、NaOH溶液、BaCl2溶液以除去粗盐中的Ca2+、Mg2+、SO42-。
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 28g N2所含有的原子数为NA
B. 标准状况下,22.4 L水中含有的水分子数为NA
C. 500 mL 1.0 mol/L碳酸钠溶液中所含Na+的数为0.5NA
D. 49g纯硫酸所含有的氧原子数与标况下22.4L CO2中所含有的氧原子数相等
难度: 中等查看答案及解析
-
科学家刚刚发现了某种元素的原子,其质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是 ( )
A. 该原子的摩尔质量是aNA B. Wg该原子的物质的量一定是
C. Wg该原子中含有
个该原子 D. 由已知信息可得:
[
难度: 中等查看答案及解析
-
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
A. 3∶2∶2 B. 1∶2∶3 C. 1∶3∶3 D. 3∶1∶1
难度: 简单查看答案及解析
-
将质量分数为a%,物质的量浓度为c1 mol/L的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol/L,则c1和c2的数值关系是( )
A. c2=c1 B. c2<c1 C. c2>2c1 D. 无法确定
难度: 困难查看答案及解析
-
同温同压下,ag甲气体和2ag乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是
A. 同温同压下甲和乙的密度之比为1∶1
B. 甲与乙的相对分子质量之比为1∶1
C. 同温同体积下等质量的甲和乙的压强之比为1∶1
D. 等质量的甲和乙中的原子数之比为1∶1
难度: 中等查看答案及解析
-
符合下图中阴影部分的物质是( )

A. CO2 B. HCl C. Na2CO3 D. 乙醇
难度: 中等查看答案及解析
-
在某无色酸性溶液中能大量共存的一组离子是
A. NH4+、SO42-、Al3+、NO3- B. Na+、K+、HCO3-、NO3-
C. Na+、Ca2+、NO3- 、CO32- D. K+、Cu2+、NH4+、NO3-
难度: 中等查看答案及解析
-
下列离子方程式或电离方程式的书写正确的是( )
A. NaHSO4熔融:NaHSO4 = Na++H++SO42-
B. Al(OH)3酸式电离:Al(OH)3 = 3OH—+Al3+
C. 向Na2CO3溶液中滴入少量稀盐酸:CO32-+2H+ = H2O+CO2↑
D. Ca(HCO3)2溶液与少量NaOH溶液反应:OH-+HCO
+Ca2+ = CaCO3↓+H2O
难度: 中等查看答案及解析
-
以下说法不正确的是( )
A. 取用金属钠或钾时,没用完的钠或钾要放回原瓶
B. CaCO3难溶于水,而Ca(HCO3)2易溶于水,因此NaHCO3和Na2CO3的溶解度关系为:NaHCO3 > Na2CO3
C. 将铝箔在酒精灯上加热,可观察到铝箔熔化但不掉落,原因是表面形成了高熔点的氧化膜。
D. 酸雨的形成是因为排放了大量的S、N的氧化物引起的。
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 油条中可添加明矾,说明明矾对人体是无害的。
B. 用食醋清洗热水瓶胆内壁附着的水垢,说明醋酸的酸性强于碳酸的酸性。
C. 苏打和小苏打焰色反应的现象是相同的,说明在灼烧过程中它们发生了相同的化学变化。
D. 液氨管道泄漏可用湿润的蓝色石蕊试纸进行检验。
难度: 中等查看答案及解析
-
用下列方法配制相应的溶液,所配制的溶液浓度偏高的是 ( )
①用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸;
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线;
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液;
④向80 mL水中加入18.4 mol/L硫酸20 mL,配制3.68mol/L的硫酸溶液;
⑤质量分数为5x%和x%的两种氨水等体积混合配制成3x%的氨水
A. ①③⑤ B. ②③ C. ③④ D. ④⑤
难度: 困难查看答案及解析
-
某国外化学教材中有一张关于氧化还原反应的插图:由图可知,
在该反应中是( )

A. 还原剂 B. 氧化剂
C. 氧化产物 D. 还原产物
难度: 简单查看答案及解析
-
2FeS + 6H2SO4(浓) = Fe2(SO4)3 + 2 S ↓ + 3SO2 ↑ + 6H2O ,下列说法正确的是( )
A. 反应中氧化产物为Fe2(SO4)3和SO2
B. 氧化剂和还原剂的物质的量之比为3:1
C. 反应中每产生32g沉淀转移电子的数目为2NA
D. 反应中被Fe还原的硫酸和被S还原的硫酸之比1:2
难度: 中等查看答案及解析
-
O2、CH4和CO的混合气体在标准状况下的密度为1.25g/L,这三种气体的物质的量之比不可能为( )
A. 3:1:2 B. 6:2:3 C. 3:4:6 D. 9:3:7
难度: 困难查看答案及解析
-
下列各项操作中,能出现沉淀,且沉淀不消失的是( )
①向饱和碳酸钠溶液中通入过量的CO2;
②向NaAlO2溶液中逐滴加入过量的NaHSO4溶液;
③向AlCl3溶液中逐滴加入过量浓氨水;
④向明矾(KAl(SO4)2)溶液中逐滴加入过量的Ba(OH)2溶液;
⑤向NaAlO2溶液中逐渐通入CO2 至过量
⑥将一小块Na投入Fe2(SO4)3溶液中
A. 全部 B. ②③④⑤ C. ①③⑤⑥ D. ①③④⑤⑥
难度: 中等查看答案及解析
-
用图中所示的装置进行实验,实验现象与预测不一致的是( )
选项
①中的物质
②中的物质
预测现象
A
浓氨水
FeCl3溶液
②中有红褐色沉淀
B
浓氨水
浓盐酸
③中有白烟
C
浓硝酸
淀粉KI溶液
②中溶液无明显变化
D
浓盐酸
酚酞溶液
②中溶液无明显变化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向含有0.1 mol·L-1 AlCl3和0.3 mol·L-1 NH4Cl的混合液1 L中加入0.1 mol·L-1 NaOH溶液 (纵坐标为沉淀的物质的量,横坐标为加入试剂的体积)正确的是( )
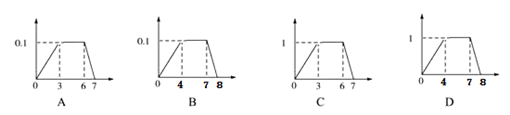
A. A B. B C. C D. D
难度: 中等查看答案及解析