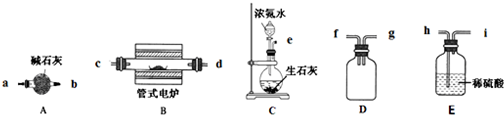
-
下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol--1,则氢气的燃烧热为241.8kJ•mol-1
C.已知2C(s)+2O2(g)=2CO2(g)△H=a 2C(s)+O2(g)=2CO(g)△H=b,则a>b
D.已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定难度: 中等查看答案及解析
-
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下.
下列结论正确的是( )步骤 操作 现象 (1) 用pH试纸检验 溶液的pH大于7 (2) 向溶液中滴加氯水,再加入CCl4振荡,静置 CCl4层呈橙色 (3) 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 (4) 过滤,向滤液中加入AgNO3溶液和稀HNO3 有白色沉淀产生
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②
C.不能确定的离子是①③⑤
D.不能确定的离子是③⑤⑥难度: 中等查看答案及解析
-
下列实验操作与预期实验目的或所得实验结论一致的是( )
选项 实验操作 实验目的或结论 A 向AlCl3溶液中加入过量的NaOH溶液,过滤,洗涤,干燥,加热 制取Al2O3 B 将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水 检验气体产物中的CO2 C 分别向等量的A、B两种白色粉末中,加入等体积、等浓度的稀盐酸 区分Na2CO3、NaHCO3两种固体 D 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 验证亚硫酸的不稳定性
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列表示物质结构的化学用语或模型正确的是( )
A.8个中子的氧原子的核素符号:O
B.HF的电子式:
C.K+离子的结构示意图: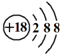
D.CH4分子的球棍模型:
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.lmol Na2O2晶体中共含有4NA个离子
B.0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.电解精炼铜时每转移NA个电子,阳极溶解32g铜难度: 中等查看答案及解析
-
下列说法正确的是( )
A.有一澄清的碱性溶液,作离子鉴定时得出的结论是含有:AlO2-、Fe3+、HCO3-
B.某固体加入热NaOH溶液,生成使湿润红色石蕊试纸变蓝的气体,则固体中一定含有NH4+
C.固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中含较多的HCO3-
D.某溶液中加入BaCl2溶液出现不溶于稀HNO3的白色沉淀,则该溶液中一定含有SO42-难度: 中等查看答案及解析
-
进行下列实验,由实验现象得出的结论错误的是( )
选项 操作及现象 溶液可能是 A 通入CO2,溶液变浑浊.再升高至70℃,溶液变澄清. C6H5ONa溶液 B 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失. Na2SiO3溶液 C 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去. Ca(ClO)2溶液 D 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊. Ca(OH)2溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3:5,则参加反应的Cl2与NaOH物质的量之比为( )
A.8:11
B.3:5
C.1:2
D.18:8难度: 中等查看答案及解析
-
含化合价为+5价的A元素的某氧化剂被亚硫酸钾还原,如果有0.003摩+5价的A元素被还原为较低价态,需用0.5mol/L的亚硫酸钾溶液15ml,则A元素被还原后的化合价是( )
A.-2
B.0
C.+4
D.+2难度: 中等查看答案及解析
-
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的( )
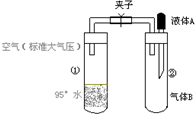
A.亚硫酸钠溶液、氯气
B.水、二氧化氮
C.氢氧化钠溶液、一氧化氮
D.氢氧化钠溶液、氨气难度: 中等查看答案及解析
-
有关下列图象说法正确的是( )

A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小
B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系
C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响.可知反应物N2的转化率最高的是b点;T1>T2,K2>K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数)
D.图4表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1氨水的pH随加入盐酸体积的变化难度: 中等查看答案及解析
-
有机物M的结构简式如图所示.下列说法中正确的是( )
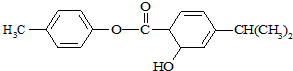
A.分子式为C17H18O3
B.M中所有碳原子均可能在同一平面
C.M可以发生加成、取代、消去等反应
D.1mol M常温下最多可以与3 mol NaOH反应难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)是工业制硫酸的主要反应之一.一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示.
下列判断中,正确的是( )甲 乙 丙 起始物质的量 n(SO2)/mol 0.4 0.8 0.8 n(O2)/mol 0.24 0.24 0.48 SO2的平衡转化率/% 80 α1 α2
A.甲中反应的平衡常数小于乙
B.该温度下,平衡常数值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率难度: 中等查看答案及解析
-
25℃时,在1.0L浓度均为0.01mol•L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中,不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol•L-1
D.n(A-)+n(OH-)=0.01 mo1+n(H+)难度: 中等查看答案及解析
-
如图所示,下列叙述正确的是( )

A.X与滤纸接触处变红
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.Y为阴极,发生还原反应难度: 中等查看答案及解析
-
将amolNa2O2和bmolNaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应.当剩余固体为Na2CO3、NaOH,排出气体为O2、H2O时,
值可能为( )
A.0.5
B.0.65
C.0.85
D.1.0难度: 中等查看答案及解析