-
下列说法不正确的是( )
A.研究物质的性质,常用观察、实验、分类、比较等方法;研究物质的结构,常利用模型、假说等方法
B.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
C.硅是将太阳能转化为电能的常用材料
D.先开发资源再治理环境的发展理念符合可持续发展的基本国策难度: 中等查看答案及解析
-
下列说法正确的是( )
A.淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
B.从形式上看,酯化反应也属于取代反应
C.油脂的相对分子质量都较大,所以属于高分子化合物
D.乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同难度: 中等查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A.无色溶液中:[Ag(NH3)4]+、K+、H+、NO3-
B.能与铝片反应产生氢气的溶液中:Al3+、Cl-、Fe2-、NO3-
C.常温下,pH=12的溶液中:SO32-、Cl-、K+、SiO32-
D.含有较多Fe3+的溶液中:Na+、SO42-、SCN-、I-难度: 中等查看答案及解析
-
下列对相关化学反应的离子方程式的评价正确的是( )
编号 化学反应 离子方程式 评价 A 过氧化钠与水反应 2O22-+2H2O=4OH-+O2↑ 正确 B 漂白粉溶液中通入过量SO2 ClO-+H2O+SO2=HSO3-+HClO 正确 C 醋酸铵溶液中加入盐酸 CH3COONH4+H+=CH3COOH+NH4+ 错误,醋酸铵不应写成化学式 D NaHCO3 溶液呈碱性 HCO3-+H2O⇌H2CO3+OH- 错误,应放出CO2
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
已知X、Y、Z为三种主族元素,分别形成Xn+、Ym+、Zn-三种离子,已知m>n且X、Y、三种原子的M层电子数均为奇数.下列说法中不正确的是( )
A.三种离子中,Ym+离子的半径最小
B.Z的最高价氧化物的水化物的分子式为HnZO4
C.X、Y、Z一定在同一周期,且原子半径Z>X>Y
D.三种元素相应的最高价氧化物的水化物之间可能会两两发生反应难度: 中等查看答案及解析
-
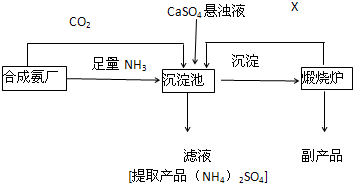
“轻轨电车”是近年新兴的一种交通工具(如图所示)当电车开动时,在电车与架空电线的接触点上,由于高速摩擦会产生高温,因此接触点上的材料应该具有现耐高温,能导电的性质,你认为该接触点上材料的应选用较为合适的是( )
A.金刚石
B.铝
C.石墨
D.铜难度: 中等查看答案及解析
-
2008年北京奥运会主体育场---“鸟巢”使用了高强度的钒氮合金高新钢的884块ETRE膜,并采用了新一代的氮化镓高亮度LED材料.下列有关说法正确的是( )
A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知镓(Ga)处于IIIA族,可推知氮化镓化学式为Ga3N2
C.ETFE膜([CH2-CH2-CF2-CF2]n)是由两种单体缩聚而成的
D.用金属铝与V2O5在高温条件下可以冶炼钒,铝作还原剂难度: 中等查看答案及解析
-
下列各项中的两个量,其比值一定为2:1的是( )
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积
B.相同温度下,pH=1与pH=2的硫酸溶液中的c(H+)
C.在过氧化钠固体中,阳离子和阴离子的个数
D.在碳与浓硫酸(加热)的反应中,参加反应的H2SO4与被还原的H2SO4的物质的量难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下的3.36L氯气与2.7g铝充分反应,转移电子数为0.3NA
B.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
C.标准状况下,22.4LD2中含有NA个中子
D.1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32-难度: 中等查看答案及解析
-
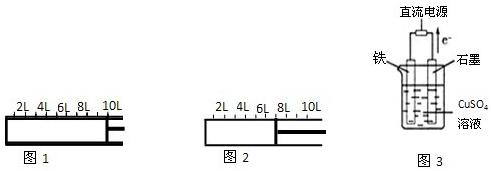
关于下列各实验装置图的叙述中,正确的是( )
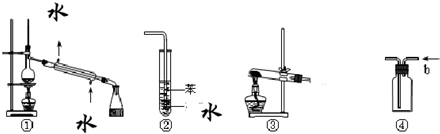
A.装置①常用于分离沸点不同且互溶的液体混合物
B.装置②可用于吸收HCl气体,并防止倒吸
C.以NH4Cl为原料,装置③可用于实验室制备少量NH3
D.装置④中从B口进气可用排水法收集NO2、CO等气体难度: 中等查看答案及解析
-
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2.有关它们的叙述 ①离子半径Na+>N3->H+;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构.其中正确的是( )
A.②③④⑤
B.①③⑤
C.②④
D.③难度: 中等查看答案及解析
-
在浓盐酸中H3AsO3与SnCl2反应的离子方程3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M.关于该反应的说法中正确的组合是( )①氧化剂是H3AsO3;②还原性:Cl->As;③每生成0.1mol As,反应中转移的电子的物质的量为0.3 mol.④M为OH-.
A.①③
B.①②④
C.②③④
D.只有①难度: 中等查看答案及解析
-
下列对实验现象的表述正确的是( )
A.将装有等量的NO2与N2O4混合气体的两个容积相同的玻璃球分别浸入热水和冷水中,浸入热水中的玻璃球里气体颜色较浅
B.红热的铜丝可以在氯气中燃烧,生成黑色的固体
C.将稀盐酸滴到二氧化锰固体上立即产生黄绿色气体
D.将白色的硫化锌固体浸入硫酸铜溶液中,会发现固体逐渐变为黑色难度: 中等查看答案及解析
-
下列溶液中,微粒的物质的量浓度关系正确的是( )
A.等体积等物质的量浓度NaF溶液与HF混合:2c(Na+)=c(F-)+c(HF)
B.0.1mol•L-1pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.等物质的量浓度的(NH4)2SO4和(NH4)2CO3溶液中的c(NH4+):前者<后者难度: 中等查看答案及解析
-
工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制得工具书盐酸,流程复杂且造成能量浪费.有人设想利用原电池原理直接制盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
A.两极材料都用石墨,用稀盐酸做电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极反应式这Cl2+2e-→2Cl-难度: 中等查看答案及解析
-
下列表格中的各种情况,可以用下面的图象曲线表示的是( )
反应 纵坐标 甲 乙 A 相同质量的氨,在同一容器中
2NH3⇌N2+3H2氨气的转化率 500℃ 400℃ B 等质量钾、钠分别与足量水反应 H2质量 钠 钾 C 在体积可变的恒压容器中,体积比1:3的N2、H2,
N2+3H2⇌2NH3氨气的浓度 活性高的
催化剂活性一般的
催化剂D 2molSO2和1molO2,在相同温度下
2SO2+O2⇌2SO3SO3物质的量 2个大气压 10个大气压
A.A
B.B
C.C
D.D难度: 中等查看答案及解析