-
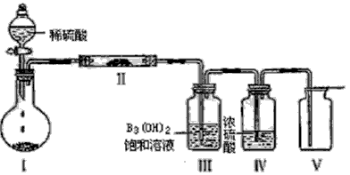
加热NH4HCO3固体,使产生的气体依次通过盛有过量Na2O2的干燥管、浓H2SO4的洗气瓶,最后得到的气体是( )
A.O2 B.NH3 C.CO2 D.CO2和O2
难度: 简单查看答案及解析
-
关于胶体和溶液的本质区别,下列叙述中正确的( )
A.溶液呈电中性,胶体带电荷
B.溶液中通过一束光线出现明显光路,胶体中通过一束光线没有特殊现象
C.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
D.溶液与胶体的本质区别在于分散质微粒直径大小,前者小于1nm,后者介于1nm~100nm之间
难度: 简单查看答案及解析
-
实现下列变化需要加入还原剂才能实现的是( )
A.Fe2O3→Fe
B.Cu→Cu(NO3)2
C.SO3→H2SO4
D.KClO3→KCl
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.0.1 molNa2O2与足量的CO2充分反应转移的电子数为0.2NA
B.0.1 mol铁在0.1 mol Cl2中充分燃烧,有0.3NA个电子转移
C.等物质的量的钠分别在足量的氧气和氯气中燃烧,转移的电子数相等
D.1.5 mol NO2与足量H2O反应,转移的电子数为2NA
难度: 中等查看答案及解析
-
已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质量分数将( )
A.大于40%
B.等于40%
C.小于40%
D.无法确定
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++
CaCO3↓
B.NH4HSO3溶液与足量NaOH溶液混合加热:
+
+2OH-
NH3↑+
+2H2O
C.酸性条件下KIO3溶液与KI溶液反应生成I2:
+5I-+3H2O
3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3・H2O
AgOH↓+
难度: 中等查看答案及解析
-
某强酸性溶液中可能存在NO3-、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,溴被还原,由此可推断该溶液中( )
A.不含NO3-,可能含Fe3+
B.含有NO3- 、I-、Cl-
C.含I-,但不能确定是否含Cl-
D.含有Fe3+
难度: 中等查看答案及解析
-
做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+C2O42-+H+-→CO2↑+Mn2++□。关于此反应的叙述正确的是( )
A.该反应的氧化剂是C2O42-
B.该反应右边方框内的产物是OH-
C.该反应电子转移总数是5e-
D.配平该反应后,H+的系数是16
难度: 中等查看答案及解析
-
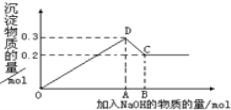
某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子。若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是
A.CH3COO- B.SO32- C.CO32- D.HCO3-
难度: 中等查看答案及解析
-
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸③苯酚钠溶液与CO2 ④硝酸银溶液与氨水⑤氯化铝溶液与氨水 ⑥碳酸氢钠溶液与澄清的石灰水.
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
难度: 中等查看答案及解析
-
由钠、镁、铝、锌四种金属单质中的两种组成的合金共12g,跟足量的盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是( )
A.Na B.Mg C.Al D.Zn
难度: 中等查看答案及解析
-
对于反应4FeS2+11O2
2Fe2O3+8SO2,下列叙述正确的是( )
A.铁和硫两种元素被还原
B.只有硫元素被氧化
C.转移电子总数是44e-
D.Fe2O3为氧化产物,SO2为还原产物
难度: 中等查看答案及解析
-
取ag某物质在足量的氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ag。下列物质中不能满足上述结果的是
A.H2 B.CO C.C12H22O11 D.C6H12O6
难度: 中等查看答案及解析
-
若溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
难度: 中等查看答案及解析
-
把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是
A.1:1 B.3:4 C.9:8 D.4:3
难度: 中等查看答案及解析
-
某学生用NaHCO3和KHCO3组成的某固体混合物进行实验,测得如下表数据(盐酸的物质的量浓度相等):
实验编号
①
②
③
盐酸体积
50mL盐酸
50mL盐酸
50mL盐酸
m(混合物)
9.2g
16.56g
27.6g
V(CO2)(标准状况)
2.24L
3.36L
3.36L
分析表中数据,下列说法不正确的是( )
A.由①可以计算出盐酸的物质的量浓度
B.由②、③可知:混合物质量增加,气体体积没有变化,说明盐酸已经反应完全
C.由①、②可知:①中的固体不足而完全反应
D.由①可以计算出混合物的NaHCO3的质量分数
难度: 中等查看答案及解析