-
下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂白纸浆
B. NaHCO3能与碱反应,可用作焙制糕点的膨松剂
C. Fe2(SO4)3易溶于水,可用作净水剂
D. 液氨汽化时吸收大量的热,可用作制冷剂
难度: 中等查看答案及解析
-
下列物质的分类结果全部正确的是( )
A. 水煤气-混合物 胆矾-纯净物 臭氧-单质
B. 纯碱-碱 硫化氢-酸 小苏打-酸式盐
C. 油脂-高分子化合物 纤维素-天然高分子化合物 有机玻璃-合成高分子化合物
D. 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B. 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数约为1.5NA个
C. 7.8 g Na2O2 含有的阴离子数目为0.1 NA
D. 80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA
难度: 简单查看答案及解析
-
实验室里需用480 mL 0.10 mol·L-1 CuSO4溶液,现选用500 mL容量瓶进行配制,以下操作正确的是( )
A. 称取7.68 g硫酸铜,加入500 mL水 B. 称取12.0 g胆矾配制500 mL溶液
C. 称取8.0 g硫酸铜,加入500 mL水 D. 称取12.5 g 胆矾配制500 mL溶液
难度: 简单查看答案及解析
-
下列现象或事实可用同一原理解释的是( )
A. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B. SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
C. 漂白粉和水玻璃长期暴露在空气中变质
D. 氢氧化铁液溶胶和蛋白质溶液中分别加入硫酸铜溶液时均产生沉淀
难度: 中等查看答案及解析
-
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应
②弱酸与盐溶液反应可生成强酸
③没有水生成,也没有沉淀和气体生成的复分解反应
④两种酸溶液充分反应后的溶液呈中性
⑤有单质参加的非氧化还原反应
⑥两种含氧化合物反应的产物有气体
A. ①②③④⑤⑥ B. ②④⑤⑥ C. ①②③⑤ D. ③④⑤⑥
难度: 中等查看答案及解析
-
实验室制取下列气体的实验正确的是( )
A. 实验室制氯气 B. 实验室制氧气 C. 实验室制氨气 D. 实验室制二氧化碳
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是( )
A. 用20mL量筒量取15mL酒精,加水5mL,配制质量分数为75%的酒精溶液(P<1)
B. 在200mL某硫酸盐溶液中,含有1.5NA个硫酸根离子,同时含有NA个金属离子,则该硫酸盐的物质的量浓度为2.5mol·L-1
C. 实验中需用2.0mol·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分数分别为950mL、201.4g
D. 实验室配制500mL 0.2mol·L-1的硫酸亚铁溶液,其操作是:用天平称15.2g绿矾(FeSO4•7H2O),放入小烧杯中加水溶解,转移到500mL容量瓶、稀释、定量、摇匀
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A. S
SO3
H2SO4 B. NH3
NO
HNO3
C. SiO2
Si
SiCl4
Si D. 海水
Mg(OH)2
2Mg
难度: 中等查看答案及解析
-
下列表述正确的是
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生
②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长
③氧化镁可用来制造耐火砖和坩埚等
④明矾能使水中的悬浮物凝聚,可做为净水剂
⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料
⑥给机动车安装尾气净化器,可减少光化学烟雾的发生
A. ①④⑤ B. ①②④⑤ C. ②③④⑥ D. 全部
难度: 中等查看答案及解析
-
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的
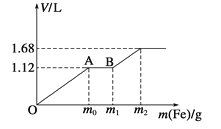
A. 开始时产生的气体为H2
B. AB段产生的反应为置换反应
C. 所用混合溶液中c(HNO3)=0.5mol·L-1
D. 参加反应铁粉的总质量m2=5.6 g
难度: 中等查看答案及解析
-
使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ②⑤ B. ②③⑥ C. ①⑤⑥ D. ③⑥
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. 向 Fe2(SO4)3 溶液中加入过量铁粉:Fe3++Fe=2Fe2+
D. 向 Na2SiO3 溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na
难度: 中等查看答案及解析
-
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 10(b-2a)mol·L-1 B. 10(2a-b)mol·L-1 C. 10(b-a)mol·L-1 D. 0.1(b-2a)mol·L-1
难度: 中等查看答案及解析
-
类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知
类推
A
将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+
将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+
B
向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C
用惰性电极电解NaCl溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
用惰性电极电解MgBr2溶液:2Br-+2H2O
2OH-+H2↑+Br2
D
稀盐酸与NaOH溶液反应至中性:H++OH-=H2O
稀HNO3与Ba(OH)2溶液反应至中性:H++OH-=H2O
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
A. 分别在这两种物质的溶液中,加入少量澄清石灰水
B. 分别加热这两种固体,并将生成的气体通入澄清石灰水中
C. 分别在这两种物质的溶液中,加入少量氯化钙溶液
D. 分别在这两种物质的等浓度的溶液中,加入等量的稀盐酸
难度: 中等查看答案及解析
-
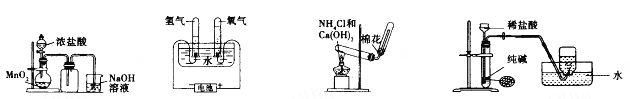
学用下列装置制备并检验Cl2的性质
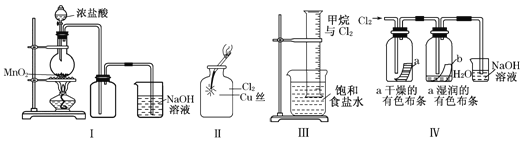
下列说法正确的是
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完
B.Ⅱ图中:生成蓝色的烟
C.Ⅲ图中:量筒中发生了加成反应
D.Ⅳ图中:湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
难度: 中等查看答案及解析
-
把一块镁铝合金投入到1mol•L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol•L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
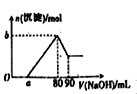
A. 盐酸的体积为80mL B. a的取值范围为0<a<50
C. n(Mg2+)≥0.025mol D. 当a值为30时,b值为0.01
难度: 困难查看答案及解析
-
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子,其物质的量浓度比为c(Na+):c(Mg2+):c(Cl-)=3∶4∶5,若Na+的物质的量浓度为3mol·L-1,则SO42-的物质的量浓度为( )
A. 2 mol·L-1 B. 3 mol·L-1 C. 4 mol·L-1 D. 8 mol·L-1
难度: 中等查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.生成沉淀完全时消耗NaOH溶液的体积为100mL
B.参加反应的硝酸的物质的量为0.1mol
C.开始加入合金的质量可能为16.4g
D.标况下产物NO的体积为22.4 L
难度: 困难查看答案及解析