-
化学与生活密切相关,下列说法正确的是
A.氢氧化铝、氢氧化镁可做抗酸药
B.加碘食盐中添加的是碘化钾
C.味觉上具有酸味的食物就是酸性食物
D.凡含有食品添加剂的食物对人体健康均有害
难度: 中等查看答案及解析
-
铝和铝合金是生活中常用的材料,下列说法正确的是
A.铝合金的熔点比纯铝高 B.铝合金的硬度比纯铝小
C.镁铝合金腐蚀时,镁先于铝被腐蚀 D.常温下可用铝制容器盛装浓硫酸
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是
A.10 g H18 2O含有的中子数为5NA
B.1 mol羟基(-OH)含有的电子数为10NA
C.1 mol 氯气参加反应时,电子转移数目一定为2NA
D.标准状况下,11.2L己烷含有的分子数为0.5NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.植物油可用于萃取溴水中的溴
B.氨基酸和蛋白质既能与酸反应又能与碱反应
C.淀粉、纤维素的化学式均为(C6H10O5)n,二者互为同分异构体
D.蔗糖、麦芽糖、淀粉和纤维素都能水解,最终水解产物都为葡萄糖
难度: 中等查看答案及解析
-
25℃时,下列溶液中水的电离程度最小的是
A.0.01 mol/L盐酸 B.0.01 mol/L Na2CO3溶液
C.pH = 4 NaHSO3溶液 D.pH =11氨水
难度: 中等查看答案及解析
-
下列解释物质用途的反应方程式不正确的是
A.用Fe2(SO4)3净水 Fe3+ + 3H2O
Fe(OH)3 + 3H+
B.用Na2S处理含Hg2+废水 Hg2+ + S2-
HgS↓
C.用Na2CO3溶液处理水垢中的CaSO4 Ca2+ + CO32-
CaCO3↓
D.燃煤时加入石灰石,减少SO2排放 2CaCO3 + 2SO2 + O2
2CaSO4 + 2CO2
难度: 中等查看答案及解析
-
下列说法正确的是
A.丁烷的沸点高于丙醇
B.聚丙烯的结构简式为
C.
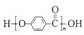 由苯酚和甲酸缩聚而成
由苯酚和甲酸缩聚而成D.可用新制的Cu(OH)2鉴别乙醛、乙酸、乙醇
难度: 中等查看答案及解析
-
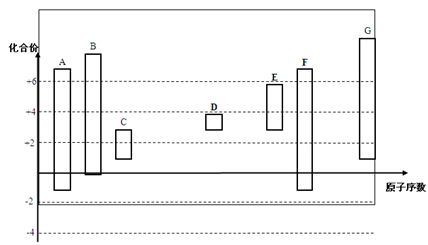
短周期元素X、Y、Z在周期表中所处的位置如图所示,三种元素的原子质子数之和为32,下列说法正确的是
X
Z
Y
A.三种元素中,Z元素的最高价氧化物对应的水化物的酸性最强
B.X、Z两种元素的气态氢化物相互反应的产物是共价化合物
C.三种元素对应的气态氢化物中,Z元素形成的氢化物最稳定
D.Y元素的气态氢化物与Y的最高价氧化物对应的水化物不可能发生反应
难度: 困难查看答案及解析
-
下列实验的现象及结论不正确的是
A.过氧化钠放置在空气中,最终转变为白色粉末Na2CO3
B.SO2通入BaCl2溶液中产生白色沉淀BaSO3
C.打磨过的铝箔和未打磨的铝箔分别在空气中灼烧,两种铝箔均熔化但不滴落,说明氧 化铝熔点比铝高
D.分别向等物质的量浓度的Na2CO3和NaHCO3溶液中滴加酚酞,溶液都变红,Na2CO3溶液红色较深,说明Na2CO3水解程度大于NaHCO3
难度: 中等查看答案及解析
-
在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如下图所示,下列说法正确的是
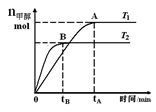
A.平衡常数K=
B.该反应在T1时的平衡常数比T2时的小
C.任意时刻,T2温度下的反应速率均大于T1温度下的速率
D.处于A点的反应体系从T1变到T2,达到平衡时
增大
难度: 困难查看答案及解析
-
现有室温下四种溶液,有关叙述不正确的是
编号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.Va L ④溶液与Vb L ②溶液混合(近似认为混合溶液体积=Va + Vb),若混合后溶液
pH = 4,则Va : Vb = 11 : 9
难度: 困难查看答案及解析
-
下图装置可用于收集气体并验证其化学性质,下列对应关系完全正确的是

选项 气体 试剂 现象 结论
A. NO 紫色石蕊试液 溶液变红 NO与水反应生成硝酸
B. C2H4 溴水 溶液褪色 乙烯能与溴发生加成反应
C. SO2 酸性KMnO4溶液 溶液褪色 SO2有还原性
D. NH3 MgCl2溶液 产生白色沉淀 NH3有碱性
难度: 中等查看答案及解析
-
下述实验能达到预期目的的是
编号 实验内容 实验目的
A 取两只试管,分别加入4 mL 0.01 mol/L KMnO4酸性溶液,然后向一只试管中加入0.1 mol/L H2C2O4溶液
2 mL,向另一只试管中加入0.1 mol/L H2C2O4溶液
4 mL,记录褪色时间 证明草酸浓度越大反应速率越快
B 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 证明Na2CO3溶液中存在水解平衡
C 向1mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L
FeCl3溶液,又生成红褐色沉淀 证明在相同温度下,溶解度Mg(OH)2 >Fe(OH)3
D 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 证明非金属性S>C
难度: 中等查看答案及解析
-
将反应Cu (s) + 2Ag+ (aq)
Cu2+ (aq) + 2Ag (s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是
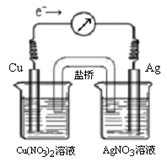
A.KNO3盐桥中的K+移向Cu(NO3)2溶液
B.当电流计指针为0时,该反应达平衡,平衡常数K=0
C.若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D.若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
难度: 中等查看答案及解析