-
下列有关物质的性质与应用均正确的是
A.MgO的熔点很高,可用于制作耐高温材料
B.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
C.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥
D.SO2和Cl2都能使品红溶液褪色,两者等体积混合可以增强漂白能力
难度: 中等查看答案及解析
-
2012年世界环境日中国主题是:绿色消费,你行动了吗?下列做法不符合该主题的是
A.开发利用太阳能、生物质能等清洁能源
B.推广垃圾的分类回收,研发各种材料再生技术
C.减少对化石燃料的依赖,有效降低PM2.5对环境的污染
D.充分开发利用纯天然纤维,停止使用各种化学合成材料
难度: 中等查看答案及解析
-
下列有关化学用语表示不正确的是
A.氧的原子结构示意图:
B.Na2O2的电子式:
C.HClO的结构式:H-O-Cl
D.中子数为16的硫离子:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
C.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42-
D.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO-
难度: 困难查看答案及解析
-
下列说法不正确的是
A.水解反应NH4++H2O
NH3·H2O+H+达到平衡后,升高温度平衡正向移动
B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率
C.明矾水解生成Al(OH)3胶体,可用作净水剂
D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0
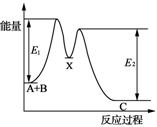
难度: 简单查看答案及解析
-
用下列实验装置和方法进行相应实验,能达到实验目的的是
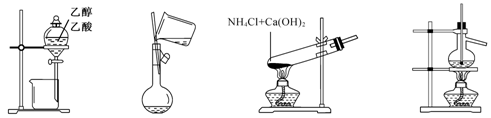
图1 图2 图3 图4
A.用图1所示装置分离乙醇与乙酸
B.用图2所示的装置向容量瓶中转移液体
C.用图3所示的装置制备少量氨气
D.用图4所示的装置分馏石油
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是
①SiO2
Na2SiO3
H2SiO3
②Fe
Fe2O3
Fe2(SO4)3
③BaSO4
BaCO3
BaCl2
④AlCl3
Al
NaAlO2
⑤HCHO
HCOOH
HCOOCH3
A.①②③ B.②③⑤ C.③④⑤ D.①③⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法中正确的是
A.在密闭容器中加入1 mol N2和3 mol H2,充分反应生成NH3分子数为2NA
B.标准状况下,4.48 L N2所含的共用电子对数0.2NA
C.常温常压下,1 mol NaHSO4晶体中含有2NA个离子
D.标准状况下,1 mol Fe与2.24 L Cl2反应转移的电子数为3NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.碘水中通入足量的SO2:I2 +SO2+2H2O=2I-+SO42-+4H+
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
B.铅蓄电池在放电过程中,负极质量增加,正极质量减少
C.100 mL pH=3的HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA酸性比HB弱
D.已知
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
难度: 中等查看答案及解析
-
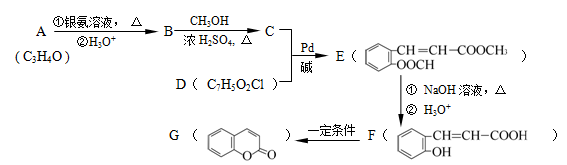
增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。
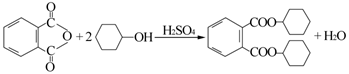
邻苯二甲酸酐 DCHP
下列说法正确的是
A.邻苯二甲酸酐的二氯代物有3种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP最多可与含2 mol NaOH的溶液反应
难度: 困难查看答案及解析
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素
的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中常用的金属材料。下列说法正确的是
A.原子半径的大小顺序:rX> rY> rW> rQ
B.元素Q和Z能形成QZ2型的共价化合物
C.工业上常用电解的方法制备X、Y的单质
D.X、Y的最高价氧化物的水化物之间不能反应
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论不正确的是
选项 实验操作 实验现象 结 论
A 测定等浓度的Na2CO3和Na2SO3 溶液的pH 前者pH比后者的大 非金属性:S>C
B SO2通入酸性高锰酸钾溶液 高锰酸钾溶液褪色 SO2具有漂白性
C 溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 出现淡黄色沉淀 溴乙烷发生了水解
D 向等浓度的KBr、KI混合液中滴加AgNO3溶液 先出现黄色沉淀 Ksp(AgBr)> Ksp(AgI)
难度: 中等查看答案及解析
-
在一密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)
Ni(CO)4(g),已知该反应在25℃和80℃时的平衡常数分别为
5×104和2,下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
难度: 中等查看答案及解析
-
已知在相同条件下酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3—。下列表述不正确的是
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中:c(Na+)=c(CN-),则a一定大于b
C.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
D.25℃时,pH=4.75,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(
)+c(
)<c(CH3COOH)+c(H+)
难度: 困难查看答案及解析
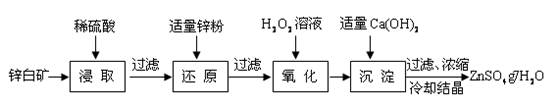
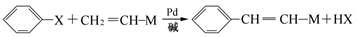 (X为卤原子,M为烃基或含酯基的取代基等)
(X为卤原子,M为烃基或含酯基的取代基等)