-
下列关于化学反应的自发性叙述中正确的是
A. 焓变小于0而熵变大于0的反应肯定是自发的
B. 焓变和熵变都小于0的反应肯定是自发的
C. 焓变和熵变都大于0的反应肯定是自发的
D. 熵变小于0而焓变大于0的反应肯定是自发的
难度: 简单查看答案及解析
-
在体积固定的密闭容器中进行可逆反应2NO2
2NO+O2,下列能作为反应达到平衡状态标志的是( )
①单位时间内生成nmol O2的同时生成2n mol NO2
②单位时间内生成n mol O2 的同时生成2n mol NO
③用NO2 、NO、O2表示的反应速率之比为2∶2∶1
④混合气体的颜色不再改变 ⑤混合气体的密度不再改变
⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变
A.①④⑥⑦ B.②③⑤⑦ C.①③④⑤ D.全部
难度: 中等查看答案及解析
-
下列物质属于电解质且又能导电的是( )
A. 硝酸钾溶液 B. 液态的氯化氢
C. 熔融的氯化钠 D. 金属铜
难度: 困难查看答案及解析
-
25℃时在五份蒸馏水中分别加入适量的下列物质,所得实验结果如下表所示:
加入物质
HCl(aq)
FeCl3
NaOH
HCOONa
C2H5OH
溶液的pH
3
4
10
11
未测定
水的电离程度
α1
α2
α3
α4
α5
加入物质后水的电离程度由大到小排列顺序正确的是
A.α3>α1>α5>α2>α4 B.α4>α2>α5>α1>α3
C.α4>α2>α5>α3>α1 D.α1>α3>α5>α2>α4
难度: 中等查看答案及解析
-
关于各图的说法(其中①③④中均为惰性电极)正确的是( )
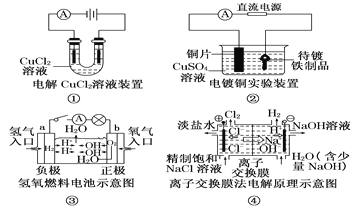
A. ①装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝
B. ②装置中待镀铁制品应与电源正极相连
C. ③装置中电子由b极流向a极
D. ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
难度: 困难查看答案及解析
-
常温下,有甲、乙两份体积均为1L、浓度均为0.1mol·L-1的醋酸溶液,其pH为3,①甲用蒸馏水稀释到100L时,溶液的pH变为x;②乙与等体积、浓度为0.2mol·L-1的NaOH溶液混合,在混合液中:n(CH3COO-)+n(OH-)-(H+)=y mol。x、y的正确答案组合为
A. 3<x<5、0.2 B. 3<x<5、0.1 C. 3、0.1 D. 5、0.2
难度: 困难查看答案及解析
-
室温下,将1 mol Na2CO3·10H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1 mol Na2 CO3(s)溶于水会使溶液温度升高,热效应为△H2;Na2CO3·10H2O受热分解的化学方程式为Na2CO3·10H2O (s)
Na2CO3(s)+10H2O(1),热效应为△H3。则下列判断正确的是( )
A.△H2 <△H3 B.△H1>△H3 C.△Hl+△H3=△H2 D.△H1+△H2>△H3
难度: 中等查看答案及解析
-
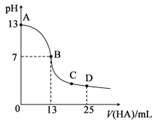
常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH的关系如右图所示。下列说法正确的是
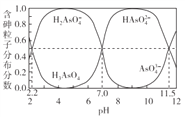
A. H3AsO4的第一步电离常数Ka1>0.01
B. pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0
C. 0.1mol·L-1H3AsO4溶液的pH<2
D. pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
难度: 困难查看答案及解析