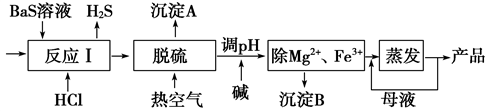
-
化学与日常生活密切相关,下列说法错误的是( )
A. 氢氧化铝可作抗酸药 B. “84”消毒液的有效成分是NaClO
C. 浓硫酸可刻蚀石英制艺术品 D. 酱油中添加的补铁剂中含有维生素C
难度: 中等查看答案及解析
-
下列试剂中,标签上应标注
 和
和 的是( )
的是( )A. CH3COOH B. HNO3 C. Na2CO3 D. HCl
难度: 简单查看答案及解析
-
在下列给定条件的溶液中,可以大量共存的一组离子是:( )
A. pH=13的溶液中:NH4+、NO3— 、K+、SO42—
B. 含Fe3+的溶液中:CO32—、NO3—、HCO3—、Na+
C. 强碱性溶液中:Na+、ClO—、AlO2—、NO3—
D. pH=1的溶液中:Cr O42—、K+、Na+、S2O32—
难度: 中等查看答案及解析
-
X、Y、Z、R、W是原子序数依次增大的五种短周期元素。Y和R同主族,可形成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25 ℃时,0.1 mol/L X和W形成化合物的水溶液pH为1,下列说法正确的是( )
A. Y和其他四种元素均可形成至少两种二元化合物
B. R元素的最高价氧化物的水化物酸性最强
C. 原子半径:X<Y<Z<R<W
D. Y、Z、W三种元素组成化合物的水溶液一定显碱性
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 某烷烃的命名为:2-甲基-3-乙基丁烷
B. 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理不同
C. 乙烯分别使溴水和酸性 KMnO4 溶液褪色, 反应类型相同
D. 油脂是能发生水解反应的高分子化合物
难度: 中等查看答案及解析
-
已知下表中烷烃的某种同分异构体的一氯代物都只有一种结构,依据表中物质的分子式推测表中第六项应该为( )
1
2
3
4
5
6
7
8
CH4
C2H6
C5H12
C8H18
C17H36
……
C53H108
C80H162
A. C22H46 B. C26H54 C. C30H62 D. C32H66
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是( )
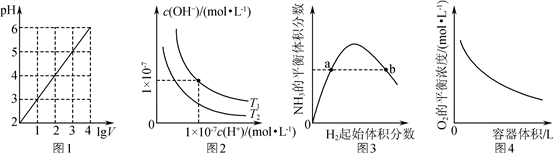
A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 困难查看答案及解析
-
Na2HPO4/Na3PO4的混合溶液可以将体系的pH稳定在11.3~13.3之间,是一种常用的缓冲溶液。下列有关该缓冲溶液的说法或关系式错误的是( )
A. 加入少量强碱,发生反应:HPO42-+OH-===PO43-+H2O
B. c(Na+)+c(H+)=c(OH-)+c(H2PO4-)+2c(HPO42-)+3c(PO43-)
C. 加入少量强酸,发生反应:HPO42-+H+===H2PO4-
D.
c(Na+)>c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)>
c(Na+)
难度: 困难查看答案及解析