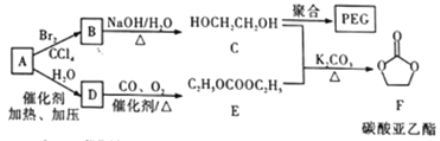
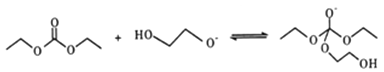
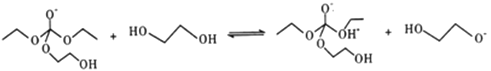
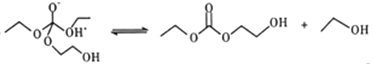
-
下列相关实验的说法正确的是
A. 用酒精灯将MgSO4溶液蒸干、灼烧至恒重,最终剩余固体是MgO
B. 向NaAlO2溶液中滴入NaHCO3溶液可析出Al(OH)3沉淀,说明AlO2-结合质子的能力比CO32-强
C. 向废铁屑溶于浓盐酸所得溶液中加人酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+
D. 将铂丝用硫酸洗净后,在外焰上灼烧至没有颜色,再蘸取碳酸钾灼烧,可直接观察到火焰呈紫色
难度: 中等查看答案及解析
-
化学与社会、生活密切相关,下列说法中错误的是
A. “歼-20”飞机上使用的碳纤维由石墨微晶组成,是一种新型有机高分子材料
B. 碳化硅俗称金刚砂,可用作砂纸,砂轮的磨料
C. 用氯气对自来水消毒,生成的有机氧化物可能对人体有害,现已研究试用ClO2、O3等新型消毒剂
D. 硫化氢是一种大气污染物,腐败的鱼、肉蛋,阴沟、粪池都有硫化氢气体产生
难度: 中等查看答案及解析
-
药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是
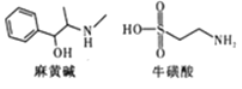
A. 分子式分别为 C10H16ON、C2H7NO2S
B. 均能与金属钠及氢氧化钠溶液反应
C. 均能发生取代反应,麻黄碱还能发生加成反应
D. 牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
难度: 中等查看答案及解析
-
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是

A. a的最高价氧化物与e的最高价氧化物结构相似,都为酸性氧化物且不能与任何酸反应
B. b、c、d、f四种元素的简单离子半径比较: f>b>c>d
C. c、d分别与f组成的化合物均为离子化合物
D. a、f的氧化物对成的水化物酸性及气态氢化物的稳定性f>a
难度: 中等查看答案及解析
-
镓(Ga)是第四周期IIIA族元素,高纯镓是一种重要的半导体基础材料。工业上采用周期反向电解法制备99.999%—99.9999%的高纯镓。“造液阶段”以金属镓(含Zn、Fe、Cu、Al、Ca等杂质)为阳极,铂为阴极。NaOH溶液为电解液,电解制备含CaO2-的电解液并除去大部分杂质,同时在阴极可析出金属镓。已知活动顺序: Al>Ga。下列有关“造液阶段”的说法正确的是
A. 阳极只发生反应: Ga+4OH--3e-=GaO2-+2H2O
B. 阳极泥的主要成分是Zn、Fe、Cu、Al
C. 阴极增加的质量等于阳极减少的质量
D. 阴极的电极反应式为: 2H2O +2e- =H2↑+2OH-,GaO2-+2H2O +3e-=Ga+4OH-
难度: 困难查看答案及解析
-
为探究NaHCO3、Na2CO3与1mol/L盐酸反应过程中的热效应,实验测得如下数据:
序号
试剂/35 mL
固体
混合前温度/℃
混合后温度/℃
①
水
2.5g (0.030mol) NaHCO3
20.0
18.5
②
水
3.2g (0.030mol) Na2CO3
20.0
24.3
③
盐酸
2.5g NaHCO3
20.0
16.2
④
盐酸
3.2g Na2CO3
20.0
25.1
由此得出的结论错误的是
A. Na2CO3溶液与盐酸的反应是放热反应
B. HCO3-(aq)+H+(aq)=CO2(g)+H2O(1) △H>0
C. 含2.5gNaHCO3的饱和溶液(20.0℃)和35mL1mol/L'盐酸(20.0℃)混合后的温度将高于16.2℃
D. 含3.2gNa2CO3的饱和溶液(20.0℃)和35mL1mol/L 盐酸(20.0℃)混合后的温度将高于 25. 1℃
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=
]。下列说法正确的是

A. K2FeO4、H2FeO4都属于强电解质
B. 25℃,H2FeO4+H+
H3FeO4+的平衡常数K>100
C. 由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D. A.C 两点对应溶液中水的电离程度: C
难度: 困难查看答案及解析
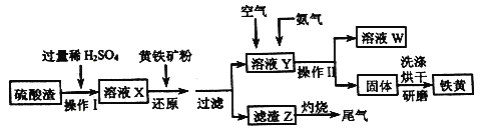
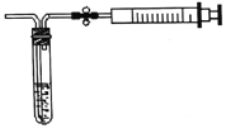
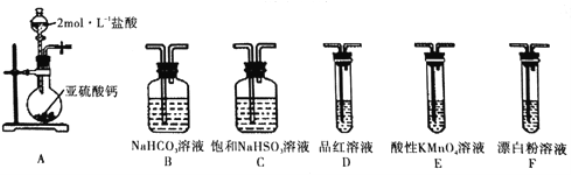
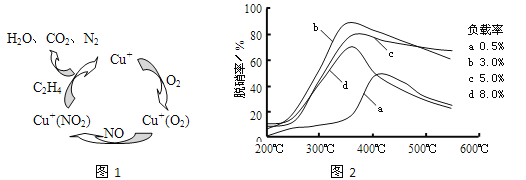
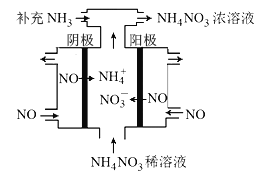
 。
。