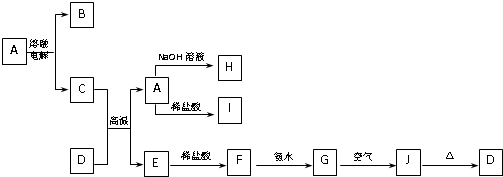
-
25℃时,水的电离达到平衡:H2O⇌H++OH-;△H>0,下列叙述正确的是( )
A.向水中加入氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变难度: 中等查看答案及解析
-
已知一种[H+]=1×10-3摩/升的酸和一种[OH-]=1×10-3摩/升的碱溶液等体积混和后溶液呈酸性.其原因可能是( )
A.浓的强酸和稀的强碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐难度: 中等查看答案及解析
-
空气是人类生存所必需的重要资源.为改善空气质量而启动的“蓝天工程”得到了全民的支持.下列措施不属于“蓝天工程”建设的是( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防治扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加高工厂的烟囱,使烟尘和废气远离地表难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.铜可导电,所以铜是电解质
B.MgCl2在水溶液中和熔融状态下均可导电,它是电解质
C.HCl、H2SO4液态时都不导电,都是非电解质
D.能导电的单质一定是金属难度: 中等查看答案及解析
-
进行中和滴定时,需用的仪器事先不应该用所盛溶液润洗的是( )
A.酸式滴定管
B.碱式滴定管
C.量筒
D.锥形瓶难度: 中等查看答案及解析
-
下列变化中,必须加入氧化剂才能发生的是( )
A.Al→Al3+
B.SO32-→SO2
C.Na+→Na
D.NH4+→NH3难度: 中等查看答案及解析
-
下列反应既是离子反应,又是氧化还原反应的是( )
A.氯化钠溶液中滴入硝酸银溶液
B.铁片置于氯化铜溶液中
C.金属镁在氧气中燃烧
D.氢氧化铝与稀硫酸反应难度: 中等查看答案及解析
-
下列各离子方程式中,属于水解反应的是( )
A.HS-+H2O⇌H2S+OH-
B.HCO3-+H2O⇌H3O++CO32-
C.HCO3-+OH-═CO32-+H2O
D.NH3+H2O⇌OH-+NH4+难度: 中等查看答案及解析
-
2005年美国《Science》上发表论文,宣布发现了一种Al的超原子结构,这种超原子(Al13)是以1个Al原子在中心,12个Al原子在表面形成的三角二十面体结构.这种超原子具有40个价电子时最稳定.请预测稳定的Al13所带的电荷为( )
A.3+
B.2+
C.0
D.1-难度: 中等查看答案及解析
-
合成氨时,既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是( )
①减压 ②加压 ③升温 ④降温 ⑤及时从平衡混合物中分离出NH3 ⑥充入N2或H2⑦加催化剂 ⑧减小N2或H2的量.
A.①③⑤
B.②⑥
C.②⑤⑧
D.②③⑦难度: 中等查看答案及解析
-
实验是研究化学的基础,下图中所示的实验方法、装置或操作完正确的是( )
A.
干燥Cl2
B.
吸收HCl
C.
制取Fe(OH)2沉淀
D.
稀释浓H2SO4难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.pH=1的溶液中:Fe2+、Al3+、HCO3-、MnO4-
B.某无色溶液中:K+、NO3-、Cl-、NH4+
C.含有大量OH-的溶液中:Na+、Cu2+、AlO2-、SO42-
D.常温下由水电离出的c(H+)=10-10 mol•L-1的溶液中:Na+、Cl-、S2-、SO32-难度: 中等查看答案及解析
-
下列反应的现象描述与离子方程式都正确的是( )
A.金属镁与稀盐酸反应,有氢气产生:Mg+2H++2Cl-═MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应,有白色沉淀产生:Ba2++SO42-═BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出:Na2CO3+2H+═2Na++H2O+CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色:Fe+Fe3+═2Fe2+难度: 中等查看答案及解析
-
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g) 不能说明该反应已达到平衡的标志是( )
A.容器内X、Y、Z的物质的量浓度之比为1:2:2
B.容器内各物质的物质的量浓度不随时间变化
C.容器内气体的压强不随时间变化
D.单位时间内消耗0.1mol X同时消耗0.2mol Z难度: 中等查看答案及解析
-
根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( )
①Cl2+2KI═I2+2KCl
②2FeCl3+2HI═I2+2FeCl2+2HCl
③2FeCl2+Cl2═2FeCl3
④I2+SO2+2H2O═2HI+H2SO4.
A.Cl2>I2>Fe3+>SO2
B.Fe3+>Cl2>I2>SO2
C.Cl2>Fe3+>I2>SO2
D.Cl2>Fe3+>SO2>I2难度: 中等查看答案及解析
-
氢氧燃料电池是一种新型电池,具有能量转化率高,燃烧产物为水,不污染环境等优点.有关该电池的说法中正确的是( )
A.通入氢气的电极为负极
B.电流从氢电极流向氧电极
C.反应中电子从氧转移给氢
D.反应中电能转化成了化学能难度: 中等查看答案及解析
-
现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中,产生气泡都很慢;把C、D 分别浸入稀硫酸中,产生气泡都很快;把A、B用导线连接时,A上有气泡析出;把C浸入D的硝酸盐溶液中,C表面有D析出.这四种金属的活动性顺序由强到弱为:( )
A.C>D>B>A
B.C>D>A>B
C.D>C>A>B
D.D>C>B>A难度: 中等查看答案及解析
-
将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)⇌2C(g),若经 2s(秒)后测得 C 的浓度为0.6mol•L-1•现有下列几种说法,正确的是( )
A.用物质A表示反应的平均速率为0.6mol•L-1s-1
B.用物质B表示反应的平均速率为0.3mol•L-1s-1
C.2s末物质A的转化率为70%
D.2s末物质B的浓度为0.7mol•L-1难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系正确的是( )
A.物质的量浓度相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中c(NH4+):c[(NH4)2SO4]>c(NH4HSO4)>c(NH4Cl)
B.向NaCN溶液中加入适量HCN,得到的碱性混合溶液:c(Na+)>c(CN-)>c(H+)>c(OH-)
C.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
D.1.0mol•L-1 Na2CO3溶液:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)难度: 中等查看答案及解析
-
如图所示,把A、B插入C的溶液中,闭合电键K后电流仪G的指针会发生偏转,且B上有气泡产生,则A、B、C可能是以下哪一组物质( )
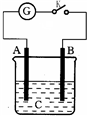
A.A-Ag;B-Fe;C-HCl
B.A-Cu;B-Zn;C-CuSO4
C.A-Zn;B-石墨;C-H2SO4
D.A-石墨;B-Zn;C-H2SO4难度: 中等查看答案及解析
-
6.4g铜与足量的浓硝酸反应(假设硝酸的还原产物只有一种),生成的气体被饱和的氢氧化钠溶液完全吸收,生成NaNO3和NaNO2,则亚硝酸钠的物质的量为( )
A.0.2mol
B.0.3mol
C.0.1mol
D.0.5mol难度: 中等查看答案及解析
-
钠、镁、铁的混合物36g,放入一定量20%的硫酸溶液恰好反应,将溶液蒸干得无水固体132g,则放出H2在标准状况下的体积为( )
A.6.72L
B.22.4L
C.11.2L
D.44.8L难度: 中等查看答案及解析
-
把80毫升NaOH溶液加入到120毫升盐酸中,所得溶液的pH值为2.如果混和前NaOH溶液和盐酸的摩尔浓度相同,它们的浓度是( )
A.0.5摩/升
B.0.1摩/升
C.0.05摩/升
D.1摩/升难度: 中等查看答案及解析
-
将等质量的a、b两份锌粉装入试管中,分别加入过量的稀硫酸,同时向装a的试管中加入少量CuSO4溶液.下图表示产生氢气的体积V与时间t的关系,其中正确的是( )
A.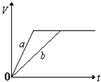
B.
C.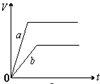
D.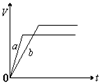
难度: 中等查看答案及解析
-
将物质的量相等的Al2(SO4)3和(NH4)2SO4溶于水,形成VL混合溶液,向该混合溶液中逐滴加入某NaOH溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量.下列各图示中,能正确表示加入NaOH溶液的体积(x)与生成沉淀的物质的量(y)的关系的是( )
A.
B.
C.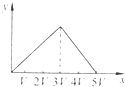
D.
难度: 中等查看答案及解析