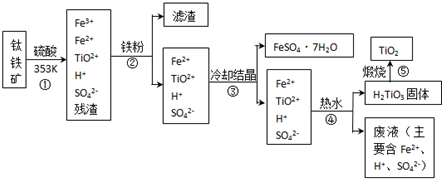
-
在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且b<c,则下列判断正确的是( )
A.最后得到的溶液中不含有Fe3
B.残余固体可能为铁、铜混合物
C.最后得到的溶液中只含Cu2+
D.残余固体一定全部是铜难度: 中等查看答案及解析
-
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源造成污染
C.不使电池中渗透的电解液腐蚀其他物品
D.回收其中石墨电极难度: 中等查看答案及解析
-
下列各反应中,生成物总能量比反应物总能量高的是( )
A.工业合成氨
B.铁生锈
C.木炭燃烧
D.电解饱和食盐水难度: 中等查看答案及解析
-
下列分散系属于胶体的是( )
A.硫酸铜溶液
B.淀粉溶液
C.云雾
D.蔗糖溶液难度: 中等查看答案及解析
-
为测定人体血液中Ca2+的含量,设计了如下方案:

有关反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O若血液样品为15mL,滴定生成的草酸消耗了0.001mol•L-1的KMnO4溶液15.0mL,则这种血液样品中的含钙量为( )
A.0.001mol•L-1
B.0.0025mol•L-1
C.0.0003mol•L-1
D.0.0035mol•L-1难度: 中等查看答案及解析
-
锂电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为
负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
A.锂电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B.在电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量最小
C.锂电池放电时电池内部Li+向负极移动
D.锂电池充电时阴极反应为C6Li1-x+xLi++xe-=C6Li难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1mol苯乙烯()中含有的碳碳双键数为4NA
B.6.2g氧化钠晶体中含有0.2NA个Na+
C.标准状况下,22.4L空气含有NA个单质分子
D.1mol•L-1NH4Cl溶液中,NH4+的数目小于NA难度: 中等查看答案及解析
-
标况下,电解一定物质的量浓度的CuSO4溶液一段时间后,加入0.2molCu(OH)2固体使溶液完全恢复到初始状态,则此过程中共产生气体( )
A.6.72L
B.8.96L
C.11.2L
D.5.6L难度: 中等查看答案及解析
-
将浓度为18.4mol/L质量分数为98%的浓硫酸加水稀释至9.2mol/L,则稀释后溶质的质量分数为( )
A.大于49%
B.小于 49%
C.等于49%
D.无法确定难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下能够进行的化学反应都是放热反应,高温下进行的反应都是吸热反应
B.常温常压下,pH=1的盐酸中约含有6.02×1023个氢离子
C.常温常压下,0.5mol氮气和氢气的混合气体体积大于11.2L
D.原电池装置的正、负极可以是同一种金属难度: 中等查看答案及解析
-
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )
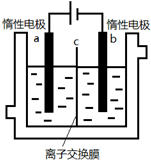
A.a电极是阴极
B.a极区的KI最终转变为KIO3
C.阳极电极反应:4OH--4e-═2H2O+O2↑
D.电解过程中OH-从a极区通过离子交换膜c进入b极区难度: 中等查看答案及解析
-
下列四种装置中,溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
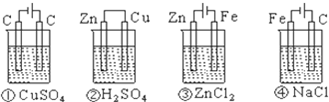
A.工作一段时间后溶质的物质的量浓度①=②=③=④
B.工作一段时间后溶液的pH:④>③=①>②
C.产生气体的总体积:④>②>①>③
D.电极上析出的固体的质量:①>②>③>④难度: 中等查看答案及解析
-
下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=-38.6 kJ•mol-1
C.HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1
D.在101 kPa时,2gH2完全燃烧生成液态水,放出285.8lkJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1难度: 中等查看答案及解析
-
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
A.放电时,负极上发生反应的物质是Fe
B.放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2
C.充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O
D.充电时,阳极附近pH值减小难度: 中等查看答案及解析
-
下列说法正确的是( )
A.使用量筒量取一定体积的浓硫酸配制一定物质的量浓度的稀硫酸,将浓硫酸转移至烧杯后须用蒸馏水洗涤量筒,并将洗涤液一并转移至烧杯
B.现需使用480ml 0.1mol/L硫酸铜溶液,则使用容量瓶配制溶液需要 7.68g硫酸铜固体
C.使用托盘天平称量固体药品时左码右物,可能会导致所配溶液浓度偏低
D.容量瓶在使用前须用待配溶液润洗难度: 中等查看答案及解析
-
14g铜金合金与足量的某浓度HNO3反应,将产生的气体用1.12L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
A.9.6g
B.6.4g
C.3.2g
D.1.6g难度: 中等查看答案及解析