-
化学与人类生活、生产密切相关,下列说法正确的是( )
A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B. 压缩天然气、液化石油气的主要成分是烃类,是城市推广的清洁燃料
C. PM2.5是指大气中直径接近2.5×10‑6m的颗粒物,其分散在空气中形成胶体
D. 干燥剂硅胶、硅橡胶和光导纤维的主要成分都是二氧化硅
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A. 25℃、101KPa下,NA个C18O2分子的质量为48g
B. 标准状况下,22.4L HF中含有的电子数为10NA
C. 加热含4molHCl的浓盐酸与足量MnO2的混合物充分反应,转移电子数2NA
D. 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. CH3(C2H5)CHCH(CH3)2的系统命名为2—甲基—3—乙基丁烷
B. 苯甲酸的结构简式为
C. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验酒后驾车
D. C5H10的同分异构体中属于烯烃的有6种
难度: 中等查看答案及解析
-
下列各组离子一定可以大量共存的是( )
A. 加铝粉产生H2的溶液:Fe2+、K+、Cl-、NO3—
B. 能使紫色石蕊试液变蓝的溶液:Na+、Al3+、SiO32-、SO42-
C. 由水电离出的c(H+)=1×10-12 mol/L的溶液:Ca2+、Pb2+、Br-、SO42—
D. 遇KSCN变红色的溶液:NH4+、Al3+、Na+、NO3-
难度: 中等查看答案及解析
-
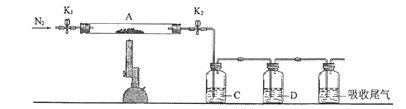
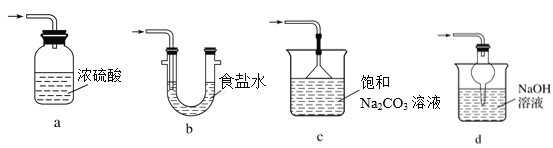
下列有关实验的说法中正确的是( )
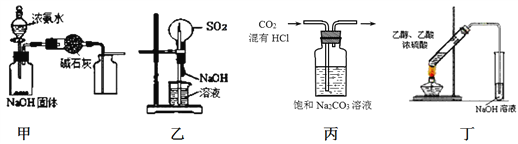
A. 用图甲装置制取干燥纯净的NH3
B. 用图乙装置可以完成“喷泉”实验
C. 图丙可除去CO2种混有的HCl气体
D. 图丁可制得并分离出乙酸乙酯
难度: 中等查看答案及解析
-
甲醇-空气燃料电池(DMFC)是一种高效、轻污染的车载电池,其工作原理如图。 下列有关叙述正确的是( )
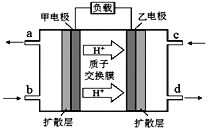
A. 该装置能将电能转化为化学能
B. 电子由甲电极经导线流向乙电极
C. 负极的电极反应式为:CH3OH+6OH--6e-
CO2+5H2O
D. b口通入空气,c口通入甲醇
难度: 中等查看答案及解析
-
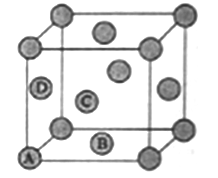
X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
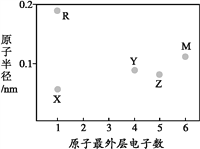
A. 简单离子半径:M<R
B. 氢化物的稳定性:Y<Z
C. M的氢化物常温常压下为气体
D. X、R、Y、Z均存在两种及两种以上的氧化物
难度: 困难查看答案及解析
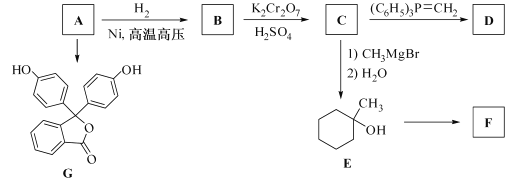
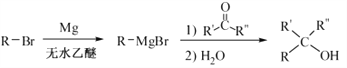
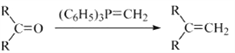 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)