-
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等 B.O2比O3的质量小
C.两种气体的分子数目相等 D.两种气体的氧原子数目相等
难度: 简单查看答案及解析
-
选用一种试剂能把浓度均为1 mol·L-1的Na2SO4、Na2SO3、Na2S2O3、Na2CO3、Na2S、BaCl2溶液加以区别,这种试剂是( )
A.CaCl2溶液 B.Ag2SO4 C.稀硫酸 D.稀盐酸
难度: 简单查看答案及解析
-
下列五种有色溶液与SO2作用,均能褪色,其实质相同的是( )
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤淀粉—碘溶液
A.①④ B.①②③ C.②③④ D.②③⑤
难度: 简单查看答案及解析
-
节能减排指的是减少能源浪费和降低废气排放,下列措施与节能减排不符合的是( )
A.工业制硫酸时,设置“废热”锅炉产生蒸气,用于发电
B.开采更多的能源,提高能源开采量
C.燃烧煤的锅炉采用类似沸腾炉的锅炉
D.推广使用乙醇汽油从而减轻大气污染,改善大气环境
难度: 简单查看答案及解析
-
实现下列变化时,需克服相同类型作用的是( )
A.纯碱和烧碱的熔化 B.水晶和干冰的熔化
C.食盐和冰醋酸的熔化 D.液溴和液汞的气化
难度: 简单查看答案及解析
-
根据相关化学原理,下列判断正确的是( )
A.若X是原子晶体,Y是分子晶体,则熔点:X<Y
B.若
═
,则氧化性:D2>A2
C.若
和
的电子层结构相同,则原子序数:R<M,离子半径:
D.若弱酸HA、HB的酸性HA>HB,则溶液的碱性NaA>NaB
难度: 简单查看答案及解析
-
下列各分子中,所有原子都满足最外电子层上有8电子的结构的是( )
A.H2O B.PCl3 C.SO2 D.BF3
难度: 简单查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是( )
A.晶体可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
难度: 简单查看答案及解析
-
在F、P、S三种元素中,每种元素都有某些方面区别于其他两种元素;若从中选出氟元素,选择的理由是( )
A.单质与冷水反应非常剧烈 B.单质固态时属于分子晶体
C.一定条件下,能与氢气发生化合反应 D.最高价氧化物对应的水化物是强酸
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同主族元素单质的熔沸点从上到下逐渐升高
D.第三周期元素的离子半径,从左到右逐渐减小
难度: 简单查看答案及解析
-
下列有关浓H2SO4性质的叙述中,错误的是( )
A.浓硫酸具有脱水性,因而能使蔗糖炭化
B.在反应HCOOH
CO↑+H2O中,浓H2SO4只表现脱水性
C.在反应Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O中,浓H2SO4只表现氧化性
D.浓硫酸具有吸水性,因而能使CuSO4·5H2O转化为CuSO4
难度: 简单查看答案及解析
-
下列反应中,调节反应物用量或浓度,不会改变反应产物的是( )
A.铁在硫蒸气中燃烧 B.H2S在空气中燃烧
C.二氧化硫通入澄清石灰水 D.硫酸中加入锌粉
难度: 简单查看答案及解析
-
检验某未知溶液是否含有
,下列操作最合理的是( )
A.加入HNO3酸化的Ba(NO3)2溶液
B.加入盐酸酸化的BaCl2溶液
C.先用盐酸酸化,若有沉淀产生,过滤,在滤液中再加BaCl2溶液
D.先加BaCl2溶液,若有沉淀产生,再加盐酸
难度: 简单查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红溶液褪色的气体。下列说法中错误的是( )
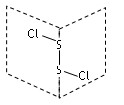
A.S2Cl2的结构式Cl—S—S—Cl
B.S2Cl2的含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可为2S2Cl2+2H2O═SO2↑+3S↓+4HCl
难度: 简单查看答案及解析
-
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互反应,图中每条连线两端的物质可以发生反应。下列判断不合理的是( )
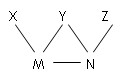
A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能为氯水
D.M、N必定各为BaCl2、FeSO4中的一种
难度: 简单查看答案及解析
-
下列化学方程式或离子方程式不正确的是( )
A.S与Cu反应 Cu+S
CuS
B.酸雨放置过程中pH变小 2H2SO3+O2═2H2SO4
C.亚硫酸氢钙溶液与澄清的石灰水混合
═CaSO3↓+H2O
D.向Na2S和Na2SO3的混合溶液中滴加稀H2SO4 [n(Na2S)∶n(Na2SO3)=2∶1]
═3S↓+3H2O
难度: 简单查看答案及解析




