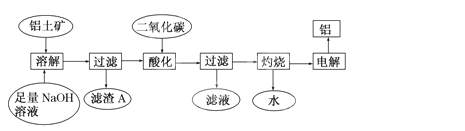
-
下列事实,不能说明氯元素的非金属性比硫元素强的是( )。
A. 氯气与氢硫酸能发生置换反应 B. HClO4酸性比H2SO4强
C. 盐酸是强酸,氢硫酸是弱酸 D. 受热时,氯化氢比硫化氢稳定
难度: 简单查看答案及解析
-
元素X的原子比元素Y的原子多一层电子,X、Y的单质都能与水激烈反应放出气体,所生成的两种气体混合点燃,会发生爆炸,X、Y形成的离子都与氖原子有相同的电子层结构,则X、Y可能是( )。
A.Na和Cl B.K和F C.Na和F D.Ca和Cl
难度: 简单查看答案及解析
-
关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在元素周期表的左下角可以寻找制备新型农药的元素
D.地球上元素的分布和它们在元素周期表中的位置有密切关系
难度: 简单查看答案及解析
-
自然界中存在的碘的稳定性核素是
I。日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素
I。一旦
I被人体吸入,就可能会引发甲状腺疾病。对于这两种核素的下列说法正确的是( )
A.
I是一种新元素 B.
I的摩尔质量为131g
C.
I和
I互为同位素 D.
I中子数与质子数之差为74
难度: 简单查看答案及解析
-
某元素的一种同位素X的质量数为A,含N个中子,它与 H原子可组成HmX分子,在ag HmX中所含电子的物质的量是( )
A. (A-N) mol B. (A-N+m) mol
C.(A-N) mol D.(A-N+m) mol
难度: 简单查看答案及解析
-
相同温度下,在两个等体积的密闭容器中,分别充入氦气、氮气两种气体,当它们的密度相同时,则氦气和氮气的物质的量之比是( )
A.7:2 B.2:7 C.1:7 D.7:l
难度: 简单查看答案及解析
-
科学家对未发现的第114号元素很感兴趣,预测它有良好的力学、光学、电学性质。以下对第114号元素的叙述正确的是( )
A.是副族元素 B.是非金属元素
C.最高正化合价为+4价 D.最外层有6个电子
难度: 简单查看答案及解析
-
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是( )。
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列各组顺序的排列不正确的是 ( )。
A.离子半径:Na+ >Mg2+ >Al3+ >F-
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱: Al(OH)3<H4SiO4<H2CO3<H3PO4
D.原子半径:K>Na>Mg
难度: 简单查看答案及解析
-
下列离子中,所带电荷数与该离子的核外电子层数相等的是( )。
A.Al3+ B.Mg2+ C.Be2+ D.H+
难度: 简单查看答案及解析
-
某溶液中只可能含有下列离子中的几种:K+ 、NH4+ 、NO3- 、SO42- 、SO32- 、CO32-,取200mL该溶液分成两等份,进行以下实验:
(1)第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
(2)第二份先加足量的盐酸无现象,再加足量的BaCl2,得到2.33g固体。
则该溶液中( )
A.可能含有K+ 、CO32- B.一定含有K+且c(K+)≥0.1mol/L
C.一定不含有NO3- D.肯定含有NO3- 、SO42- 、NH4+
难度: 简单查看答案及解析
-
铜既不溶于稀硫酸,也不溶于NaNO3溶液,但可溶于其混合液。现将1.92gCu放入足量稀硫酸中,若要使铜完全溶解,理论上至少应加入NaNO3的物质的量为( )
A.0.080 mol B.0.060 mol C.0.045 mol D.0.020 mol
难度: 简单查看答案及解析
-
.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。Y、Z同周期,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A.X的氢化物溶于水显酸性
B.Y的氧化物是离子化合物
C.X与Y形成化合物的化学式为YX
D.X和Z的最高价氧化物对应的水化物都是弱酸
难度: 简单查看答案及解析
-
为测定某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入l00mL 0.3mol·L-1稀硫酸,合金完全溶解,产生的气体在标况下为560mL;再加入0.2mol·L-1NaOH溶液至沉淀质量不再变化,用去350mLNaOH溶液。则所取样品中铝的物质的量为( )
A.0.005mol B.0.01mol C.0.025mol D.0.03mol
难度: 简单查看答案及解析
-
电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的。下列推断中正确的是( )
A.Z的氢化物的稳定性强于W的氢化物
B.Z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的离子半径依次增大
D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应
难度: 简单查看答案及解析
-
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铝和硫直接化合可以得到Al2S3;铁和硫直接化合也可以得到 Fe2S3
③不能用电解熔融的AlCl3来制取金属铝;也不能用电解熔融的MgCl2来制取金属镁
A.① B.②③ C.② D.①②③
难度: 简单查看答案及解析
-
.某学生设计了如图的方法对A盐进行鉴定:
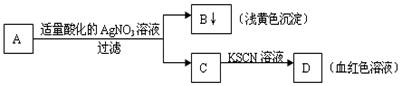
由此分析,下列结论中,正确的是( )
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
难度: 简单查看答案及解析
-
将铁片加到2L0.5mol/LFeCl3溶液中,当Fe3+和Fe2+的浓度相等时,铁片的质量减少了( )
A.2.8g B.5.6g C.11.2g D.1.4g
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A. FeCl2 、Fe(OH)3均可通过化合反应制得
B. 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C. 常温常压下,氧气和臭氧的混合物16g约含有6.02×1023个氧原子
D. NH3易液化,液氨常用作制冷剂
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.Ba(OH)2溶液与过量的NaHCO3溶液混合
Ba2++2OH-+2HCO3-BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体:
Ca2++2ClO-+SO2+H2OCaSO3↓+2HClO
C.金属钾与水反应 2K +2 H2O2K+ +2 OH-+ H2↑
D.醋酸与氢氧化钠溶液的反应 H+ + OH-H2O
难度: 简单查看答案及解析
-
将SO2通入BaCl2溶液至饱和未见沉淀,继续通入另一气体仍无沉淀,通入的气体可能是( )
A.CO2 B.NH3 C.Cl2 D.H2S
难度: 简单查看答案及解析
-
.以下实验装置一般不用于分离提纯物质的是( )
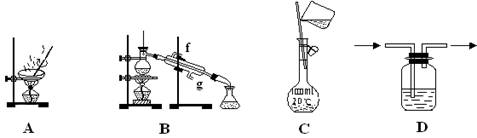
难度: 简单查看答案及解析
-
下列反应一定不会产生气体的是( )
(A)盐与碱的反应 (B)氧化物与水的反应
(C)酸溶液和碱溶液的中和反应 (D)金属与碱溶液的反应
难度: 简单查看答案及解析
-
下列表述正确的是:①二氧化硅是制造光导纤维的材料 ②工业上合成氨属于氮的固定 ③氧化铝可用来制造耐火砖和坩埚等 ④明矾可作为净水剂使水中的悬浮物凝聚 ⑤用于建筑的水泥属于硅酸盐材料 ⑥二氧化硫和二氧化氮都能形成酸雨,酸雨的pH小于5.6
A.①③④⑤⑥ B。①②④⑤ C。②③④⑥ D。①②③④⑤⑥
难度: 简单查看答案及解析
-
a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为( )
A.1 :7 B.7 :1 C.7 :8 D.8 :7
难度: 简单查看答案及解析
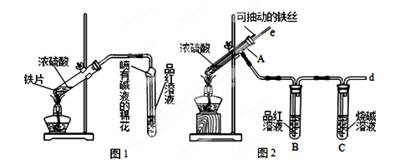
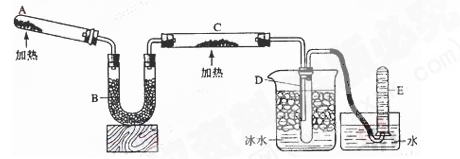
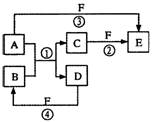 反应。
反应。