-
下列叙述正确的是( )
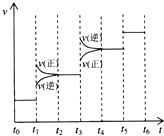
A.某醋酸溶液的PH=a,将此溶液稀释1倍后,溶液的PH=b,则a>b
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液PH<7
C.常温下,1.0×10-3mol/L盐酸的PH=3.0,1.0×10-8mol/L盐酸PH=8.0
D.若1mLPH=1盐酸与100mLNaOH溶液混合后,溶液PH=7,则NaOH溶液的PH=11难度: 中等查看答案及解析
-
在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是( )
A.m1一定大于m2
B.m1可能小于m2
C.m1可能等于m2
D.m1一定等于m2难度: 中等查看答案及解析
-
将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是( )
A.CO2
B.NH3
C.NO2
D.H2S难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮咬能够引起铅中毒
B.化学反应的过程中除了有物质的变化外还伴随着能量的变化
C.胶体与溶液的分离可用滤纸过滤的方法
D.金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火难度: 中等查看答案及解析
-
被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,这是因为( )
A.氢氟酸的酸性比其它酸强
B.氢氟酸的氧化性比其它酸强
C.氢氟酸的还原性比其它酸强
D.钛离子易与氟离子形成可溶性难电离物质难度: 中等查看答案及解析
-
总压强为3.0×107 Pa时,N2、H2混合气体(体积之比为1:3)通入合成塔中,反应达平衡时,压强降为2.5×107Pa,则平衡时混合气体中NH3的体积分数为( )
A.35%
B.30%
C.25%
D.20%难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.lmol Na2O2晶体中共含有4NA个离子
B.0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下16gO2和O3混合气体含有NA个氧原子
D.电解精炼铜时每转移NA个电子,阳极溶解32g铜难度: 中等查看答案及解析
-
有下列气体:①SO2,②H2S,③H2,④HI,⑤CO2,⑥NH3,不能用浓H2SO4干燥的是( )
A.①②④
B.②④⑥
C.①②④⑥
D.①③⑤⑥难度: 中等查看答案及解析
-
向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成不可能是( )
A.NaCl,Na2S04
B.NaCl,NaBr,Na2S04
C.NaBr,Na2S04
D.NaCl,NaI,Na2S04难度: 中等查看答案及解析
-
关于下列各实验装置的叙述中,不正确的是( )
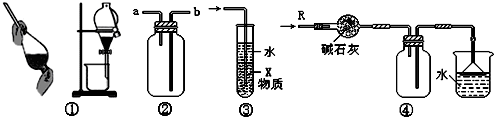
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+4OH-=SO2-3+CO32-+2H2O
B.向Ca(ClO)2溶液中通入二氧化硫Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓
C.向Fe(NO3)3溶液中加入过量的HI溶液2NO3-+8H++6I-=3I2+2NO↑+4H2O
D.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO-3+Ba2++OH-=BaCO3↓+H2O难度: 中等查看答案及解析
-
某炼金厂的废水因连降暴雨而溢出,导致河水严重污染.炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是( )
A.CN-可以和稀硫酸反应生成HCN
B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被F-还原
D.HCN的电子式为H:CN:难度: 中等查看答案及解析
-
下列实验方法合理的是( )
A.可用水鉴别NH4Cl、NaOH、NaCl三种固体
B.可用铁粉除去FeCl2溶液中的少量的CuCl2
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必须相等难度: 中等查看答案及解析
-
短周期元素A、B、C,原子序数依次递增.已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半.下列叙述正确的是( )
A.原子半径:A<B<C
B.沸点:A的氢化物低于C的氢化物
C.常温下,B的硫酸盐溶液pH<7
D.5.6g铁与足量的C化合,转移0.3mol电子难度: 中等查看答案及解析
-
盖斯定律认为能量总是守恒的,化学反应过程一步完成或分步完成,整个过程的热效应是相同的.
己知:①H2O(g)═H2O(l)△H1═Q1kJ•mol-1
②C2H 5OH(g)═C2H 5OH(l)△H2═Q 2 kJ•mol-1
③C2 H5OH(g)+3O2(g)--2CO2(g)+3H2O(g)△H3═Q3kJ•mol-1
若使23g液态酒精完全燃烧,最后恢复到室温,则放出的热量为(kJ)( )
A.Q1+Q2+Q3
B.0.5Q 2-0.5Q3-1.5Q1
C.0.5Q1-1.5Q2+0.5Q3
D.0.5(Q1+Q2+Q3)难度: 中等查看答案及解析
-
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是( )
A.恰好溶解后溶液中的NO3-离子的物质的量为mol
B.反应过程中转移的电子数为mol
C.生成NO气体的体积为L
D.与合金反应反应的硝酸的物质的量为()mol
难度: 中等查看答案及解析