-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质
难度: 中等查看答案及解析
-
下列实验操作中,错误的是( )
A. 现需80 mL 1.0 mol·L-1NaOH溶液,称取3.2 g NaOH固体配制溶液浓度偏小
B. 装标准液的滴定管未润洗,测得待测液的浓度偏大
C. 用pH试纸测得新制氯水的pH为2
D. 用酸式滴定管准确量取10.00mLKMnO4溶液
难度: 简单查看答案及解析
-
实验室欲配制100mL l.0mol/L Na2CO3溶液,下列操作正确的是( )
A. 用托盘天平称量Na2CO3•10H2O晶体10.6g,倒入烧杯中加适量的水溶解
B. 当烧杯中固体全部溶解后,立即用玻璃棒引流转移至容量瓶中
C. 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D. 若配制时,俯视液面定容,所配溶液的浓度偏高,再补加少量蒸馏水至刻度线
难度: 简单查看答案及解析
-
设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,18gH218O所含质子数为10NA
B.1 mol乙醇中含有极性键的
数目为8NA
C.1mol的﹣NH2与1molNH4+所含电子数均为10NA
D.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 简单查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列说法正确的是( )
A.KNO3是还原剂,其中N元素被氧化
B.生成物中的N2是氧化产物,K2O是还原产物
C.当氧化产物比还原产物多2.8g时,转移电子1/14 mol
D.氧化剂与还原剂的物质的量之比5:1
难度: 简单查看答案及解析
-
向含有c(FeCl3)=0.2mol•L﹣l、c(FeCl2)=0.1mol•L﹣l的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
A.该分散系的分散质为Fe2O3
B.加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH﹣═Fe3O4+4H2O
C.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
D.可用过滤的方法将黑色金属氧化物与Na+分离开
难度: 中等查看答案及解析
-
常温下,下列溶液中可能大量共存的离子组是( )
A.加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42﹣、NO3﹣
B.水电离产生的c(OH﹣)=1×10﹣10mol/L的溶液中:Al3+、SO42﹣、NO3﹣、Cl﹣
C.无色透明溶液中:Al3+、Ca2+、Cl﹣、HCO3﹣
D.含大量Fe3+的溶液中:K+、I﹣、NH4+、SCN﹣
难度: 中等查看答案及解析
-
能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于过量的浓KOH溶液中:NH4+ +OH﹣═NH3↑+ H2O
B.醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O
C.向FeBr2溶液中通入足量氯气:2Fe2++4Br﹣+3Cl2═2 Fe3++2Br2+6 Cl﹣
D.向明矾[KAl(SO4)2 ·12H2O]溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:
2Al3++3SO42﹣+3Ba2++6OH ﹣═2 Al(OH)3↓+3BaSO4↓
难度: 困难查看答案及解析
-
下列有关说法正确的是( )
A.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
B.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量 Cu(NO3)2溶液
C.N2(g)+3H2(g)⇌2NH3(g)△H<0,降低温度时:v(正)增大,v
(逆)减小,平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反 应的△S<0
难度: 简单查看答案及解析
-
下列有关反应热的叙述中正确的是( )
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.X(g)+Y(g)
Z(g)+W(s) ΔH>0,升高温度,该反应的ΔH增大
C.已知:S(s)+O2(g)=SO2(g) ΔH1,S(g)+O2(g)=SO2(g) ΔH2 则 ΔH1>ΔH2
D.甲中加入1 g SO2、1 g O2,乙中加入2 g SO2、2 g O2,在恒温恒容或恒温恒压下反应2SO2(g)+O2(g)
2SO3(g)达平衡时,乙放出的热量都等于甲的2倍
难度: 简单查看答案及解析
-
液流式铅蓄电池以可溶性的甲基磺酸铅[(CH3SO3)2Pb]代替硫酸作为电解质溶液,该电池充放电的总反应为2Pb2++2H2O
Pb+PbO2+4H+,下列说法正确的是( )
A.该电池放电时,两极质量均增加
B.放电时,正极的电极反应式为PbO2+4H++2e-
Pb2++2H2O
C.充电时,溶液中Pb2+向阳极移动
D.充电时,阳极周围溶液的pH增大
难度: 简单查看答案及解析
-
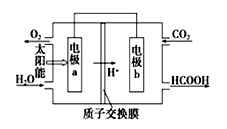
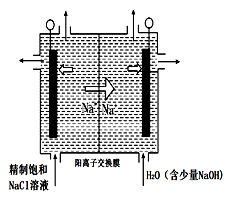
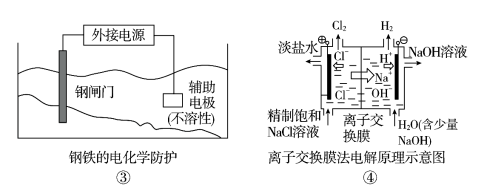
下列关于各图的说法,正确的是( )
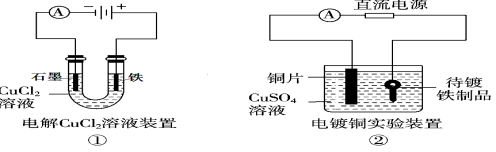
A.①中阳极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中钢闸门应与外接电源的正极相连,称为牺牲阳极的阴极保护法
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
难度: 简单查看答案及解析
-
等体积、浓度均为0.2 mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)变化如图所示。下列说法不正确的是( )

A.酸性:HB>HA>H2CO3
B.反应结束后所得两溶液中:c(A-)>c(B-)
C.上述三种溶液中由水电离的c(OH-)相对大小:NaHCO3>HA>HB
D.HA溶液和NaHCO3溶液反应所得的溶液中: c(A-)+ c(HA)=0.1 mol·L-1
难度: 简单查看答案及解析
-
已知常温下浓度为0.
1 mol·L-1的下列溶液的pH如下表所示:
溶质
NaF
NaClO
NaHCO3
Na2CO3
pH
7.5
9.7
8.2
11.6
下列有关说法不正确的是( )
A.pH=2的HF溶液与pH=12的NaOH溶液以体积比1∶1混合,则有:
c(Na+)> c(F-)> c(OH-)>c(H+)
B.加热0.1 mol·L-1 NaClO溶液测其pH,pH大于9.7
C.0.1 mol·L-1 Na2CO3溶液中,存在关系:c(OH-)=c(H+) +c(HCO
)+2c(H2CO3)
D.电离平衡常数大小关系:K(HF)> K(H2CO3 )>K(HClO)>K( HCO
)
难度: 简单查看答案及解析
-
某温度下,反应2A(g)
B(g) ΔH>0在密闭容器中达到平衡,平衡后
=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时
=b,下列叙述正确的是( )
A.若a=b,则容器中可能使用了催化剂或恒温恒容下充入惰性气体
B.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
C.若其他条件不变,升高温度,则a<b
D.若保持温度、压强不变,充入惰性气体,则a>b
难度: 简单查看答案及解析
-
恒温恒容下,向2 L密闭容器中加入MgSO4
(s)和CO(g),发生反应:
MgSO4(s)+CO(g) ⇌MgO(s)+CO2(g)+SO2(g)。反应过程中测定的部分数据见下表:
反应时间/min
n(MgSO4)/mol
n(CO)/mol
n(CO2)/mol
0
2.00
2.00
0
2
0.80
4
1.20
下列说法正确的是( )
A.反应在0~2 min内的平均速率为v(SO2)=0.6 mol·L-1·min-1
B.反应在2~4 min内容器内气体的密度没有变化
C.若升高温度,反应的平衡常数变为1.00,则正反应为放热反应
D.保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 mol CO,达到平衡时n(CO2)<0.60 mol
难度: 简单查看答案及解析