-
下列叙述正确的是( )
A.强电解质都是离子化合物,因此NaCl是离子化合物
B.醋酸溶液的导电能力可能比稀硫酸强
C.SO3溶于水,其水溶液能导电,SO3是电解质
D.硫磺是单质,不导电,因此硫磺是非电解质难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是( )
A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
B.氯化铝易溶于水是因为形成了氢键
C.氨易液化与氨分子间存在氢键无关
D.H2O是一种非常稳定的化合物,这是由于氢键所致难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.23gNa在氧气中完全燃烧失电子数为0.5NA
B.2mol•L-1的MgCl2溶液中含Mg2+数为2NA
C.常温常压下,11.2LCO2所含分子数为0.5NA
D.室温下,8g甲烷含氢原子数为2NA难度: 中等查看答案及解析
-
R、M、T、G、J为原子序数依次递增的同一短周期主族元素,下列说法一定正 确的是(m、n均为正整数)( )
A.若M的最高正化合价为+4,则五种元素都是非金属元素
B.HnJOm为强酸,则G是位于ⅤA族以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若R、M的最高价氧化物的水化物R(OH)n、M(OH)n+1均为碱,则Rn+的半径一 定比M(n+1)+半径大难度: 中等查看答案及解析
-
有关晶体的下列说法中正确的是( )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏难度: 中等查看答案及解析
-
如图表示的一些物质或概念之间的从属或包含关系中不正确的是( )
X Y Z 例 氧化物 化合物 纯净物
A.苯 芳香烃 有机化合物
B.溶液 分散系 混合物
C.强电解质 电解质 化合物
D.置换反应 氧化还原反应 离子反应难度: 中等查看答案及解析
-
如图所示,6个编号分别代表下列物质中的一种物质,凡是直线相连的两种物质均能发生化学反应(已知高温下氨气能还原氧化铁).图中⑤表示的物质是( )
a.Al;b.Fe2O3;c.NaOH溶液;d.氢碘酸溶液;e.NH3;f.Cl2.
A.a或b
B.c
C.d
D.e或f难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中共存的是( )
①无色溶液中:K+、Na+、H2PO4-、PO43-、SO42-
②使pH试纸变深蓝的溶液中:、
、Na+、S2-、
、
③水电离的c(H+)=10-12mol/L的溶液中:ClO-、、
、
、
④加入Mg能放出H2的溶液中:Mg2+、、Cl-、Na+、
⑤使甲基橙变红的溶液中:Mn、
、
、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、N、I-、Cl-、S2-.
A.①③
B.②④⑤
C.①②⑤
D.③难度: 中等查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
C.HN3与NH3作用生成的产物是共价化合物
D.与CO2含相等电子数
难度: 中等查看答案及解析
-
中学化学课本中有大量的数据材料,下面是某学生对数据的利用,其中错误的是( )
A.利用溶解度数据可判断煮沸Mg(HCO3)2溶液时,得到的产物是Mg(OH)2而不是MgCO3
B.利用密度数据可判断液态物质挥发性的大小
C.原子(或离子)半径数据可作为判断某些原子(或离子)的氧化性或还原性的依据
D.利用沸点数据可判断液态物质挥发性的大小难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素.下列叙述正确的是( )
A..四种元素的原子半径:A<B<C<D
B.最高价氧化物对应的水化物的酸性:B>D
C.C元素处于元素周期表中第3周期第ⅡA族
D.C的最高价氧化物对应的水化物是强酸难度: 中等查看答案及解析
-
在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g)⇌C(g)+3D(g)现分别从两条途径建立平衡:Ⅰ.A、B的起始量均为2mol;Ⅱ.C、D的起始量分别为2mol和6mol.下列叙述不正确的是( )
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
C.达到平衡时,途径Ⅰ的 和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径Ⅰ的气体密度为途径Ⅱ密度的1/2难度: 中等查看答案及解析
-
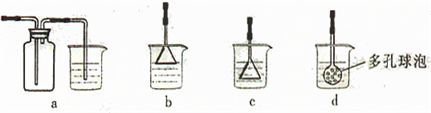
某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2,极易与H2O反应)下列说法正确的是( )
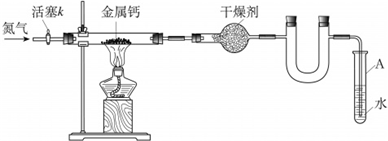
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸
C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
D.将产物Ca3N2放入盐酸中,只能得到一种盐难度: 中等查看答案及解析
-
某学生设计了如图的方法对A盐进行鉴定:
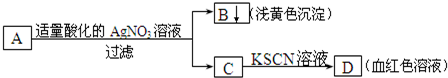
由此分析,下列结论中,正确的是( )
A.A中一定有Fe3+
B.C中一定有Fe3+
C.B为AgI沉淀
D.A一定为FeBr2溶液难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.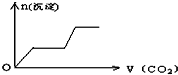
B.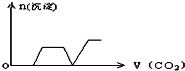
C.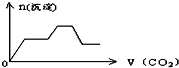
D.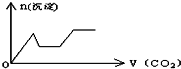
难度: 中等查看答案及解析