-
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是
A.保持表面干燥 B.表面镀锌 C.表面镶嵌铜块 D.与电源负极相连
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A.CO (g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的
ΔH=+2×283.0kJ/mol
B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57. 3)kJ/mol
C.用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 困难查看答案及解析
-
把下列物质的水溶液蒸干、灼烧后,得到的固体为原先溶质的是
A.Na2CO3 B.AlCl3 C.Na2SO3 D.NH4HCO3
难度: 中等查看答案及解析
-
有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1 mol HY酸,需要的NaOH稍小于1 mol
难度: 困难查看答案及解析
-
某反应:A
B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程△H、△S的判断正确的是
A.△H>0、△S>0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H<0、△S<0
难度: 中等查看答案及解析
-
已知H—H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,N—H键键能为391 kJ·mol-1,根据热化学方程式:N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是
A.431 kJ·mol-1 B.945.6 kJ·mol-1
C.649 kJ·mol-1 D.896 kJ·mol-1
难度: 中等查看答案及解析
-
用0.2mol/L HCl溶液滴定0.2mol/L NaOH,如果到达滴定的终点时不慎多加了1滴盐酸溶液(1滴溶液的体积约为0.05mL),继续加水至100mL,所得溶液的pH是
A.4 B.1 C.10 D.3.3
难度: 中等查看答案及解析
-
汽车上用的铅蓄电池是以一组充满海绵状态的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O
下列叙述正确的是
A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4
B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol
C.放电时溶液中H+向负极移动
D.充电时阳极附近溶液的pH减小
难度: 困难查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
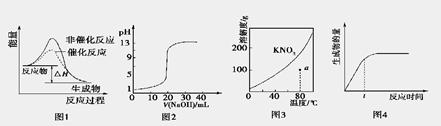
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
难度: 困难查看答案及解析
-
某学生欲完成反应2HCl+2Ag==2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是
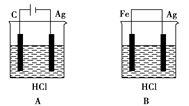
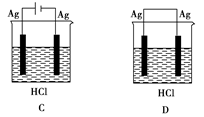
难度: 中等查看答案及解析
-
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-==4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-==Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
难度: 困难查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol /(L·s) B. υ(B)= 0.3 mol /(L·min)
C.υ(C)= 0.8 mol /(L·s) D.υ(D)= 1 mol /(L·s)
难度: 中等查看答案及解析
-
高温下,某反应达平衡,平衡常数K=
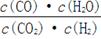 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是A.反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2O
CO2+ H2
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(气)
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减小了
C.物质B的质量分数增加了 D.a>b
难度: 困难查看答案及解析
-
能使水的电离平衡正向移动,而且所得溶液呈酸性的是
A.将水加热到100 ℃时,水的pH=6 B.向水中滴加少量稀H2SO4
C.向水中加入少量NaHCO3 D.向水中加入少量胆矾晶体
难度: 中等查看答案及解析
-
物质的量浓度相同的下列各溶液,由水电离出的c(H+)由大到小的顺序是
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④ C.③②④① D.③④②①
难度: 中等查看答案及解析
-
工业上常用还原沉淀法处理含铬废水(Cr2O72—和CrO42—),其流程为:
已知:
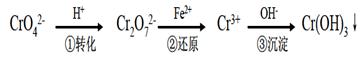
(1)步骤①中存在平衡:2CrO42—(黄色)+2H+
Cr2O72—(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在沉淀溶解平衡:Cr(OH)3(s)
Cr3+(aq)+3OH 一(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在.下列有关说法中,正确的是
A.步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42—离子浓度增大
B.步骤①中当溶液呈现深黄色,且2v(CrO42 一)=v(Cr2O72—)时,说明反应
2CrO42—(黄色)+2H+
Cr2O72—(橙色)+H2O 达到平衡状态
C.步骤②中,若要还原1 mol Cr2O72一离子,需要6 mol(NH4)2Fe(SO4)2·6H2O。
D.步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽
难度: 极难查看答案及解析
-
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.某溶液中由水电离出的c(OH-) = 1×10-amol·L-1,若a>7时,则该溶液的pH一定为14-a
B.等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合:
c(Na+) = c(SO32-) + c(HSO3-) + c(H2SO3)
C.将0.2mol·L-1的某一元酸HA溶液和0.1mol·L-1的NaOH溶液等体积混合后溶液的pH大于7,则反应后的混合液:2c(OH-)+c(A-)=2c(H+)+c(HA)
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(Na+)>2c(R2-)+c(HR-)
难度: 极难查看答案及解析
-
某溶液中由水电离产生的C(H+)=1.0×10-10mol/L,则下列各组离子在该溶液中肯定能大量共存的是:
A、K+、Na+、HCO3—、Cl— B、Na+、K+、NO3—、Cl-
C、K+、Na+、S2-、NO3— D、Mg2+、Na+、SO32—、CO32—
难度: 困难查看答案及解析
-
下列措施或事实能用勒沙特列原理解释的是
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.钢铁在潮湿的空气中生锈
C.H2、I2、HI平衡混合气加压后颜色变深
D.新制的氯水在光照下颜色变浅
难度: 中等查看答案及解析
-
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
难度: 困难查看答案及解析
-
把足量铝条放入盛有一定体积的稀盐酸的试管中,可使反应速率降低且不影响H2产生量的操作是
A.加入适量FeCl3溶液 B.加入适量KNO3溶液
C.加入适量的K2CO3溶液 D.加入适量Na2SO4溶液
难度: 中等查看答案及解析
-
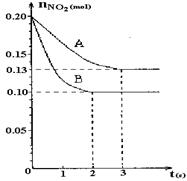
T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是
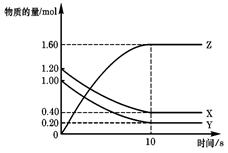
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积扩大为4 L,平衡逆向移动
C.平衡时X的正反应速率与Y的逆反应速率相等
D.T℃时,该反应的化学方程式为:X (g)+Y(g)
2Z(g),平衡常数K="40"
难度: 困难查看答案及解析