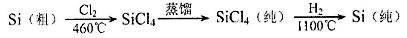-
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时的反应方程式是 ;制铝时,电解Al2O3不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
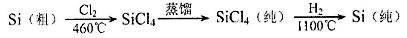
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,该反应的热化学方程式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的:
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
-
(15分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
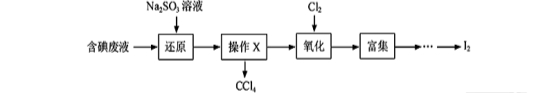
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。(1分)
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓 慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
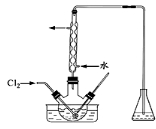
(4)利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①a为电源的 (填“正极”或“负极”),阳极的电极反应式为 。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为 。
-
(14分)A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。
(1)A在周期表位置________写出一种工业制备单质F的离子方程式:___________________。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为_______其水溶液与F单质反应的化学方程式为__________________________________.
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1∶1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
a的化学式为________;b的化学式为______________;
c的电子式为________, d是________晶体
(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为__________mol。
-
(选考)【化学——选修2:化学与技术】(15分))
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得: SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式__________
②该反应的平衡常数表达式为K=__________
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 __ (填两种物质名称),其净水作用的原理是__________
-
(选考)(15分)【化学——物质结构与性质】
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)________。
(3)气态SeO3分子的立体构型为________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的 原子杂化类型为 ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为______________________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
-
(选考)【化学——选修5:有机化学基础】(15分)化合物H可用以下路线合成:
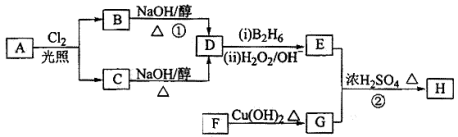
已知:
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式__
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为 ;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式 。