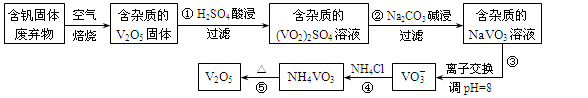
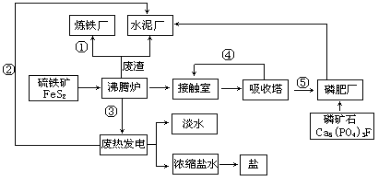
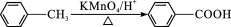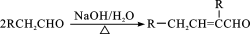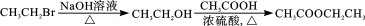-
设NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4 LSO3所含电子数约为40 NA
B.0.5 mol NH4HSO4晶体中,含有H+数目约为0.5 NA
C.92 g NO2、N2O4混合气体含有的N原子数为2NA
D.1 mol Cl2作为氧化剂得到的电子数为NA
难度: 中等查看答案及解析
-
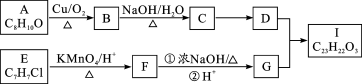
右图是一些常见有机物的转化关系,下列说法正确的是
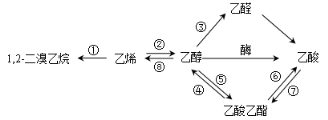
A.反应①是加成反应,反应⑧是消去反应,其它所标明的反应都是取代反应
B.上述物质中能与NaOH溶液反应的只有乙酸
C.1,2一二溴乙烷、乙烯、乙醇烃基上的氢被氯取代,其一氯取代产物都是一种
D.等物质的量的乙烯和乙醇与足量氧气反应时耗氧量相同
难度: 困难查看答案及解析
-
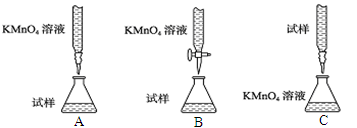
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热
无银镜生成
淀粉未发生水解
B
将一铝箔放在酒精灯外焰上灼烧
铝箔熔化但不滴落
铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al
C
铜放入稀硫酸中,再加入硝酸钠固体
开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解
硝酸钠可以加快铜与稀硫酸的反应速率
D
向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液
先生成白色沉淀,后生成黑色沉淀
溶度积(Ksp):ZnS>CuS
难度: 中等查看答案及解析
-
25℃时,将氨水与氯化铵溶液混合得到 c(NH3·H2O)+c(NH4+) = 0.1 mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述一定正确的是
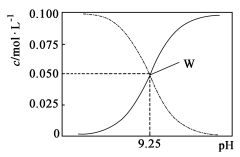
A.W点表示溶液中:c(NH4+) +c(H+) = c(OH-)
B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1
C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
D.向W点所表示1L溶液中加入0.05molNaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+)>c(OH-)>c(NH4+)>c(H+)
难度: 极难查看答案及解析
-
用惰性电极电解CuSO4溶液一段时间,停止后,向所得溶液中加入0.2molCu(OH)2,恰好使溶液恢复至电解前,关于电解过程说法不正确的是
A.生成的铜的物质的量是0.2mol B.随着电解进行溶液的pH减小
C.转移电子的物质的量为0.4mol D.阳极反应是2H2O -4e-=4H+ +O2↑
难度: 中等查看答案及解析
-
已知X、 Y、 Z、 W为短周期主族元素,在周期表中的相对位置如图,下列说法正确的是
A.若 HmXOn为强酸,则 X的氢化物溶于水一定显酸性(m、n均为正整数)
B.若四种元素均为金属,则 Z的最高价氧化物对应的水化物一定为强碱
C.若四种元素均为非金属,则 W的最高价氧化物对应的水化物一定为强酸
D.若四种元素中只有一种为金属,则 Z与 Y 两者的最高价氧化物对应的水化物能反应
难度: 困难查看答案及解析
-
现有阳离子交换膜、阴离子交换膜、石墨电极和如图所示的电解槽。用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
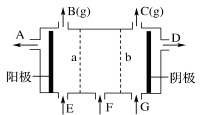
A.b是阳离子交换膜,允许Na+通过
B.从A口出来的是NaOH溶液
C.阴极反应式为4OH--4e-== 2H2O+O2↑
D.Na2SO4溶液从G口加入
难度: 困难查看答案及解析