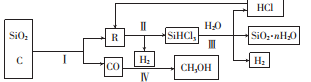
-
在如图所示的微粒中,结合电子能力最强的是
A.
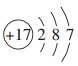 B.
B. C.
D.
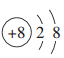
难度: 中等查看答案及解析
-
图中没有涉及到的能量转化形式是

A. 化学能转化为热能 B. 太阳能转化为化学能
C. 势能转化为电能 D. 化学能转化为势能
难度: 中等查看答案及解析
-
下列电子式书写错误的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
短周期元素的性质递变规律如图所示,下列说法正确的是
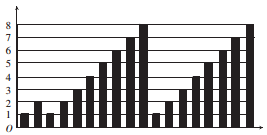
A. 横坐标为质子数,纵坐标为元素的最高正价
B. 横坐标为原子序数,纵坐标为元素原子的最外层电子数
C. 横坐标为核电荷数,纵坐标为元素原子的半径
D. 横坐标为中子数,纵坐标为元素的非金属性
难度: 中等查看答案及解析
-
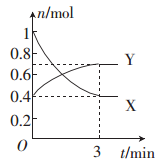
一定条件下,将1 mol X气体和1mol Y气体充人一1 L的恒容密闭容器中,发生反应:X(g)+2Y(g)
3Z(g) ,1s后测得c(Y) =0.6 mol·I-1,则0~1 s内Y的平均反应速率为
A. 0.2 mol·L-l·s-l B. 0.4 mol·L-l·s-l C. 0.6 mol·L-l·s-l D. 0.8 mol·L-l·s-l
难度: 中等查看答案及解析
-
下列说法正确的是
A. 元素的种类由最外层电子数决定
B. 化学键是存在于分子、原子和离子间的作用力
C. 原子的种类由原子核内质子数与中子数共同决定
D. 化学反应速率可以决定反应的限度
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 标准状况下,22.4 LH2O中含有极性键的数目为2NA
B. 78 g Na2O2中含有的阴离子数为NA
C. 11 g重水(D218O)中含有的电子数力5NA
D. 常温常压下,5.6 g铁粉在7.1 g氯气中充分燃烧,转移的电子数为0. 2NA
难度: 中等查看答案及解析
-
下列不能说明硫的非金属性比氯的非金属性弱的是
A. 硫酸比次氯酸稳定 B. 硫酸的酸性弱于高氯酸
C. H2S比HC1易被氧化 D. 气态HC1比气态H2S稳定
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 氯气溶于水:Cl2+H2O=2H++Cl-+ ClO-
B. 将过量氨水加入AlCl3溶液中:Al3++4OH-=AlO2-+2H2O
C. 酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O
D. 向NaHCO3溶液中加入等物质的量的Ca(OH)2:2HCO3-+Ca2++ 2OH-=CaCO3↓+ CO32-+2H2O
难度: 中等查看答案及解析
-
下列各组微粒具有相同的质子数和电子数的是
A. OH-、H2O B. NH3、NH4+ C. H3O+、NH2- D. HC1、H2S
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是
选项
实验目的
实验操作
A
称取2.0 g NaOH固体
先在左、右两托盘上各放一张滤纸,然后在有盘上添加2g砝码,左盘上添加NaOH固体
B
检验试液巾是否含有NH4+
取少量试液于试管巾,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
C
除去CO2中混有的杂质SO2
将混合气体通入盛有澄清石灰水的洗气瓶中
D
验证金属钠比铜活泼
将钠加入1.0 mol·L-1的CuSO4溶液巾
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
汽车发动机在工作时,由于电喷,在气缸中会发生反应:N2(g)+O2 (g)=2NO(g)。已知该反应过程中的能量变化如图所示,下列说法中不正确的是
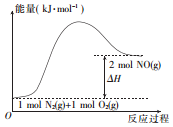
A. 该反应是放热反应 B. 该反应是氧化还原反应
C. 该反应过程中有共价键的断裂和形成 D. 使用催化剂可以改变反应速率
难度: 困难查看答案及解析
-
一定温度下,在某容器中进行如下可逆反应,当混合气体的平均摩尔质量不再改变时,说明反应达到平衡状态的是
①恒容时发生反应:A(g)+B(g)
3C(g)
②恒压时发生反应:A(g)+B(g)
2C(g)
③恒容时发生反应:A(g)+2B(g)
2C(g)+D(g)
④恒压时发生反应:A(g)+2B(g)
3C(g)J-D(s)
A. ②③ B. ①④ C. ①③ D. ②④
难度: 中等查看答案及解析
-
为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的丁作原理如图所示。下列说法正确的是
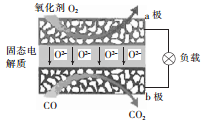
A. 电子从b极经导线流向a极
B. 正极的电极反应式为O2+4e-+2H2O=4OH-
C. 还可以选用NaOH固体作固态电解质
D. 若反应中转移1 mol电子,则生成22.4L(标准状况)CO2
难度: 困难查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是
A. W、X、Y、Z最外层电子数之和为20
B. WX2、YX2和ZX2均只含共价键
C. 原子半径的大小顺序为X<W<Y<Z
D. Z的气态氢化物比Y的稳定
难度: 困难查看答案及解析