-
下列表示正确的是
A. CH4的比例模型
 B. 二氧化碳的结构式 O—C—O
B. 二氧化碳的结构式 O—C—OC. S2—的结构示意图
D. 氯化钠的电子式
难度: 简单查看答案及解析
-
烷烃的命名是其他种类有机物命名的基础,
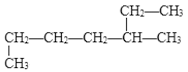 的名称是
的名称是A. 1-甲基-4-乙基戊烷 B. 2-乙基戊烷 C. 1,4-二甲基己烷 D. 3-甲基庚烷
难度: 简单查看答案及解析
-
许多国家重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是
A. 氯、溴、碘 B. 烧碱、氢气 C. 粗盐、淡水 D. 钠、镁、铝
难度: 简单查看答案及解析
-
下列物质的性质可以用“键能”来解释的是
A. SiO2熔点高 B. 氩气性质稳定
C. 碘易升华 D. NH3极易溶于水
难度: 中等查看答案及解析
-
下列有关性质的比较,错误的是
A. 酸性:H2SO4>H3PO4 B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2 D. 熔点:K>Na
难度: 简单查看答案及解析
-
乙二醇和丙三醇的有关数据见下表。则分离乙二醇和丙三醇混合液的最佳方法是
物质
分子式
熔点/℃
沸点/℃
密度/g·cm-1
溶解性
乙二醇
C2H4O2
-11.5
198
1.11
易溶于水和乙醇
丙三醇
C3H8O3
17.9
290
1.26
能跟水、酒精以任意比互溶
A. 分液 B. 蒸馏 C. 冷却至0℃后过滤 D. 加水萃取
难度: 简单查看答案及解析
-
不能用勒夏特列原理解释的是
A. 使用铁触媒,加快合成氨反应速率
B. 乙酸乙酯在碱性条件下水解比在酸性条件下水解更有利
C. 打开汽水瓶盖,即有大量气泡逸出
D. 配置FeCl3溶液时,加入少量盐酸
难度: 简单查看答案及解析
-
2A(g)
B(g) +Q(Q>0);下列能量变化示意图正确的是

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
如图所示进行实验,下列说法不正确的是
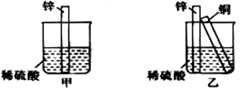
A. 装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生
B. 甲、乙装置中的能量变化均为化学能转化为电能
C. 装置乙中的锌、铜之间用导线连接电流计,可观察到电流计指针发生偏转
D. 装置乙中负极的电极反应式:Zn-2e-=Zn2+
难度: 中等查看答案及解析
-
A. 酸碱滴定时,眼睛一定要注视滴定管中液面的变化
B. 实验室制乙烯时,为使受热均匀,应轻轻搅动温度计
C. 纸上层析实验中,须将滤纸上的试样点浸入展开剂中
D. 分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 金属钠和水反应:Na+2H2O →Na++2OH—+H2↑
B. 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH—→SO32-+H2O
C. 硫酸铵溶液和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓
D. 醋酸和碳酸钙反应:2H++CaCO3 → Ca2++CO2↑+ H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W原子的最外层电子数是次外层电子数的一半。下列说法正确的是
A. 离子半径大小顺序:r(Z2+)>r(Y2-)
B. Y分别与Z、W形成的化合物中化学键类型相同
C. X的最高价氧化物对应的水化物的酸性比W的强
D. 单质的熔点Z>W
难度: 中等查看答案及解析
-
过氧化钠是一种制氧剂,它和二氧化碳反应方程式为:2Na2O2+2CO2→2Na2CO3+O2下列说法正确的是
A. Na2O2是氧化剂,CO2是还原剂
B. Na2CO3是还原产物,O2是氧化产物
C. 每转移4摩尔电子,有1摩尔氧气生成,
D. 1摩尔CO2参加反应就会产生11.2LO2
难度: 中等查看答案及解析
-
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
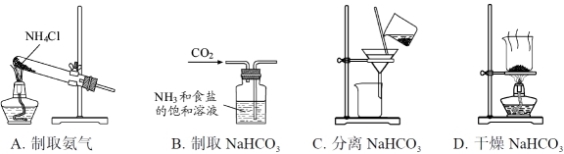
难度: 中等查看答案及解析
-
化合物X是一种医药中间体,其结构简式如图所示。
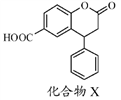
下列有关化合物X的说法正确的是
A. 分子中两个苯环一定处于同一平面
B. 不能与饱和Na2CO3溶液反应
C. 1 mol化合物X最多能与2 molNaOH反应
D. 在酸性条件下水解,水解产物只有一种
难度: 中等查看答案及解析
-
下列实验方案中,不能达到实验目的的是
选项
实验目的
实验方案
A
检验CH3CH2Br在NaOH溶液中是否发生水解
将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
C
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
D
验证AgI的溶解度小于AgCl
将NaI浓溶液加入AgCl悬浊液中,振荡,可观察到沉淀由白色变为黄色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 2.8g铁粉与50mL 4mol/L盐酸反应转移电子的数目为0.15NA
B. 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA
C. 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA
D. 1mol苯中所含碳碳双键的数目为3NA
难度: 中等查看答案及解析
-
将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是
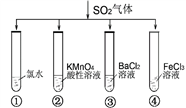
A. 试管①中有淡黄色沉淀生成,说明SO2有氧化性
B. 试管②中溶液褪色,说明SO2有漂白性
C. 试管③中能产生白色沉淀,说明SO2有酸性
D. 试管④中溶液颜色变浅,说明SO2有还原性
难度: 简单查看答案及解析
-
常温下,向20.00mL0.1000 mol·L-1的醋酸溶液中逐滴加入0.1000 mol·L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示。下列说法不正确的是
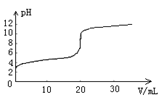
A. 在反应过程中,c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)
B. pH=5时,c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
C. pH=7时,消耗NaOH溶液的体积肯定小于20.00mL
D. pH>7时,消耗NaOH溶液的体积肯定大于20.00mL
难度: 中等查看答案及解析
-
某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.27g,在沉淀中加入过量稀盐酸,仍有2.33g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+
B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl-
D. 根据以上实验,无法确定该固体中有Na+
难度: 中等查看答案及解析



 。
。 Y ……
Y ……