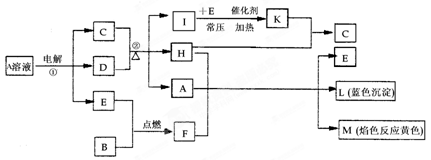
-
已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H=+255.6KJ. mol-1
b.CH3CH2OH(g)+1/2O2(g)→3H2(g)+2CO(g)△H=+13.8KJ. mol-1
则下列说法不正确的是 ( )
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源
D.由a、b知:2 H2(g)+O2(g)==2 H2 O(g)△H=-483.6KJ. mol-1
难度: 中等查看答案及解析
-
下列叙述正确的是 ( )
A、常温常压下,4.6gNO2气体约含有1.81×1023个NO2分子
B、48gO3气体含有6.02×1023个O3分子
C、0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D、标准状况下,33.6LH2O含有9.03×1023个H2O分子
难度: 中等查看答案及解析
-
对相同状况下的12C18O和14N2两种气体,下列说法正确的是 ( )
A、若质量相等,则质子数相等 B、若原子数相等,则中子数相等
C、若分子数相等,则体积相等 D、若体积相等,则密度相等
难度: 中等查看答案及解析
-
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是 ( )
①K+、Cl-、NO3-、S2- ②K+、Fe2+、I-、SO42-
③Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤K+、Ba2+、Cl-、NO3-
A、①③ B、②⑤ C、③④ D、③⑤
难度: 中等查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是 ( )
A、X的原子半径一定大于Y的原子半径
B、X与Y的简单离子不可能具有相同的电子层结构
C、两元素形成的化合物中,原子个数比不可能为1 :1
D、X2Y可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
Ba2++OH-+H++SO42-=BaSO4↓+H2O
B、用石墨作电极电解饱和食盐水 2Cl-+2H2O
Cl2↑+H2↑+2OH -
C、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液Ca2++HCO3-+OH -=CaCO3↓+H2O
D、FeSO4溶液中加H2O2溶液 Fe2++2H2O2+4H+=Fe3++4H2O
难度: 中等查看答案及解析
-
下列配制溶液的操作中,不会影响所配溶液浓度大小的是…… ( )
A、容量瓶内水分未干便注入了液体
B、托盘两边各垫一张质量相等的纸片称取固体NaOH
C、洗涤刚才盛过溶质的烧杯的洗涤液没有转入容量瓶
D、定容后使溶液混匀,静止,发现凹液面低于刻度线,立即滴蒸馏水至刻度线
难度: 中等查看答案及解析
-
下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是:( )
①金属钠投入到FeCl3溶液 ②过量NaOH溶液和明矾溶液
③少量电石投入过量NaHCO3溶液 ④Na2O2投入FeCl2溶液
A.① B.③ C.②③ D.①③④
难度: 中等查看答案及解析
-
将0.2molAgNO3、0.4molCu(NO3)2、0.6molKCl溶于水,配成100mL溶液,用惰性电极电解一段时间后,若在一极析出0.3molCu,此时在另一极上产生的气体体积(标准状况)为 ( )
A.4.48L B.5.6L C.6.72L D.7.84L
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是 ( )
A、Z的氢化物的水溶液在空气中存放易变质
B、X的氢化物没有还原性
C、Y的氧化物是共价化合物,其水化物显两性
D、X和Z的最高价氧化物对应的水化物都是具有强氧化性的酸
难度: 中等查看答案及解析
-
某恒温恒容的容器中,建立如下平衡:2NO2(g)
N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的
体积分数比原平衡时 ( )
A.都增大 B.都减小 C.前者增大后者减小 D.前者减小后者增大
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为 ( )
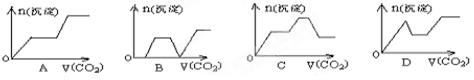
难度: 中等查看答案及解析
-
某铁的氧化物,用7mol/L的盐酸100mL在一定条件下恰好完全溶解,所得溶液再通入0.56L氯气时,刚好使溶液中Fe2+完全转化为Fe3+。则该氧化物的化学式是( )
A. FeO B. Fe3O4 C. Fe4O5 D. Fe5O7
难度: 中等查看答案及解析
-
我国古代四大发明中的黑火药为硝酸钾、硫横和木炭的混合物,黑火药发生爆炸的反应式为:2KNO3+S+3C
K2S+N2↑+3CO2↑,下列有关叙述中正确的是( )
A、在黑火药爆炸的反应中,硝酸钾为氧化剂,硫磺和木碳为还原剂
B、在黑火药爆炸的反应中,当有1molKNO3反应时,转移电子的总物质的量为5mol
C、三种反应物可以形成三种不同类型的晶体,三种生成物可以形成两种不同类型的晶体
D、在K2S晶体中,K+与S2-电子层结构相同,但K+半径大于S2-半径
难度: 中等查看答案及解析
-
锂钒氧化物电池的能量密度远远超过其它材料电池,其成本低,便于大量推广,
且对环境无污染。电池总反应式为:V2O5+xLi==LixV2O5。下列说法中,不正确的是( )
A.正极材料为锂,负极材料为V2O5
B.向外供电时,锂离子在凝胶中向正极移动
C.正极的电极反应式为:V2O5 + xLi++ xe—== LixV2O5
D.负极的电极反应式为:xLi—xe—==xLi+
难度: 中等查看答案及解析