-
下列有关叙述正确的是
A. XX化妆品从纯天然植物中提取,不含任何化学物质
B. 红宝石、玛瑙、水晶、钻石等制作装饰品的材枓,其物质的主要成份都是硅酸盐
C. 氢氧燃料电池、硅太阳能电池中都利用了原电池原理
D. 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材科
难度: 简单查看答案及解析
-
分子式为C9H8O2的芳香族化合物中能与溴水反应,并能与NaHCO3溶液反应的同分异构体有几种(不考虑立体异构)( )
A.4 B.5 C.6 D.7
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的, X和Z原子序数之和与Q的原子序数相等。下列说法正确的是
A. Z、W、Q三种元素最高价氧化物对应的水化物之间两两均可反应生成盐和水
B. X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C. 气态氢化物的稳定性:X>Y>Q
D. 相同质量的Z和W单质分别与足量稀盐酸反应时,Z的单质获得的氢气多
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列说法中正确的是
①20 g D2O含有的电子数为10NA
②含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
③1 L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
④ 在标准状况下22.4 L SO3的物质的量为1mol
⑤25℃时,pH=12的l.0LNaClO溶液中水电离出的OH-的数目为0.01NA
⑥常温下,5.6 L NO和5.6 LO2的混合气体中含有的分子数为0.5NA
⑦l mol Na2O2与水完全反应时转移电子数为2NA
A. ③⑥⑦ B. ①③⑤ C. ①②④ D. ④⑤⑥
难度: 中等查看答案及解析
-
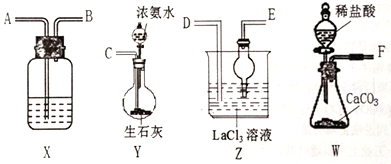
下列选用的仪器和药品能达到实验目的的是
A
B
C
D

制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线,如下图所示:
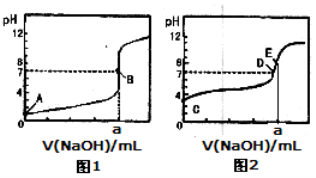
以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
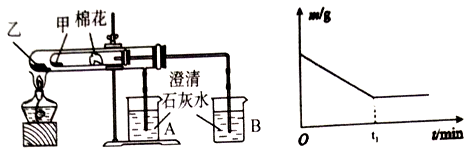
控制适合的条件,KI溶液过量,将反应
2Fe3++2I-=2Fe2++I2设计成如下图所示的原电池。下列判断正确的是
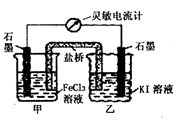
A.反应开始时,甲中石墨电极上Fe3+发生氧化反应
B.反应开始时,乙中石墨电极的反应式:I2+2e-=2I-
C.电流计读数为零时,在甲中加入KSCN溶液,出现血红色
D.电流计读数为零时,反应处在停止状态
难度: 中等查看答案及解析

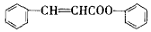 )是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如下图所示:
)是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如下图所示: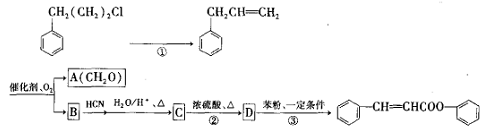
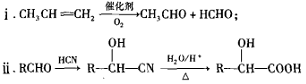
 )的合成路线______(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
)的合成路线______(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。