-
下列判断错误的是
A. 稳定性:NH3>PH3>AsH3
B. 离子半径:Li+>O2->F-
C. 酸性:H3PO4<H2SO4<HClO4
D. 碱性:LiOH<NaOH<KOH
难度: 中等查看答案及解析
-
下列反应中,起了氮的固定作用的是
A.N2和H2在一定条件下合成氨 B.由氨制成碳酸氢铵或硫酸铵
C.NO和O2反应生成NO2 D.NO2与H2O反应生成HNO3
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层为8电子结构的是 ( )
A.BF3 B.CO2 C.NH3 D.PCl5
难度: 中等查看答案及解析
-
下列微粒中:①13Al3+②
③
④F-,核外电子总数相同的是( )
A. ①②③ B. ②③④ C. ①②④ D. ①③④
难度: 中等查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A. 元素周期表含元素最多的族是第ⅢB族
B. 元素周期表有18个族
C. 第1 A族的元素全部是金属元素
D. 短周期是指第一、二、三、四周期
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.浓硫酸、浓盐酸和浓硝酸长期暴露在空气中,质量都会减小、浓度都会降低
B.氯水和活性炭都可使红墨水褪色,其原理相同
C.浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色
D.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
难度: 中等查看答案及解析
-
以下关于锂、钠、钾、铷、铯的叙述不正确的是
①氢氧化物中碱性最强的是CsOH ②单质熔点最高的是铯
③与O2反应均可得到多种氧化物 ④它们的密度依次增大,均要保存在煤油中
⑤其单质的还原性依次增强 ⑥它们对应离子的氧化性也依次增强
⑦单质与水反应的剧烈程度依次增强
A. ①⑤⑦ B. ②⑤⑥ C. ②③④⑥ D. ②③⑤⑦
难度: 简单查看答案及解析
-
下列说法正确的是
A. 离子键就是使阴、阳离子结合成化合物的静电引力
B. 所有金属与所有非金属之间都能形成离子键
C. 含有共价键的化合物一定是共价化合物
D. 含有离子键的化合物一定是离子化合物
难度: 简单查看答案及解析
-
X元素原子的L层比Y元素原子的L层少3个电子,X元素原子的核外电子总数比Y原子核外电子总数少5个,则X、Y可形成的化合物是
A. 离子化合物Y(XO4)2 B. 离子化合物Y2X3
C. 共价化合物XY2 D. 离子化合物Y3X2
难度: 中等查看答案及解析
-
下图所示各为元素周期表中的一部分,表中数字是原子序数,其中X为35的是
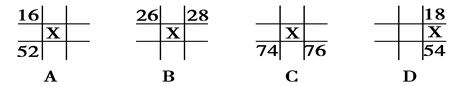
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
最近医学界通过用放射性14C标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关14C的叙述正确的是( )
A. 与C60中普通碳原子的化学性质不同 B. 与14N含的中子数相同
C. 是C60的同素异形体 D. 与12C互为同位素
难度: 中等查看答案及解析
-
在周期表中金属和非金属的分界线附近能找到
A. 制农药的元素 B. 制催化剂的元素
C. 做半导体的元素 D. 制耐高温合金材料的元素
难度: 简单查看答案及解析
-
浓硫酸分别和三种钠盐反应,下列分析正确的是
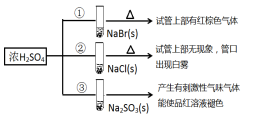
A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
难度: 中等查看答案及解析
-
X、Y、Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子,下列说法不正确的是
A. 化合物XZ3中各原子均满足8电子的稳定结构
B. X、Y、Z三种元素形成的含氧酸都是强酸
C. 常温下,Z单质可与Y的氢化物发生置换反应
D. 一定条件下,X2与Al反应得到AlX
难度: 中等查看答案及解析
-
分别处于第二、第三周期的主族元素A和B,它们的离子电子层结构相差两层,已知A处于第m族,B处于第n族,A只有正化合价,则A、B的原子序数分别是( )
A. m、n B. 3、7 C. m-2、10-n D. m+2、n+10
难度: 中等查看答案及解析
-
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
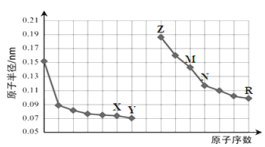
A. X与M形成的一个阴离子中含有29个电子
B. 气态氢化物沸点Y>R
C. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z单质能从M与R元素构成的盐溶液中置换出单质M
难度: 中等查看答案及解析
-
根据元素在元素周期表中的位置,运用元素周期律分析下面推断,其中错误的是
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At)为有色固体,HAt不稳定,AgAt感光性很强,不溶于水也不溶于酸
C. 锶是第五周期第ⅡA族的元素,硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒是第四周期第ⅡA族的元素,硒化氢(H2Se)是有色有毒的气体,比H2S稳定
难度: 中等查看答案及解析
-
由两种短周期元素组成的化合物,其中两种元素的原子个数比为1:3,若两种元素的原子序数分别为a和b,则a和b的关系可能是( )
①a=b+4;②a+b=8;③a+b=30;④a=b+8
A. ①②③④ B. ①③④ C. ②④ D. ③④
难度: 中等查看答案及解析
-
已知1~18号元素的离子aX m+、bYn+、cZP-、dWk-都具有相同的电子层结构,下列关系正确的是
A. 若P>K,则还原性cZP- <dWk-
B. 若m > n, 则碱性 X(OH)m > Y(OH)n
C. 若半径aX m+>bYn+ ,则a<b
D. 若半径aX m+ >bYn+ ,则X的单质一定能从含Y n+ 的盐溶液中置换出Y
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的电子式为
B. S2Cl2同时含有极性键和非极性键
C. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O = SO2↑+3S↓+4HCl
难度: 困难查看答案及解析