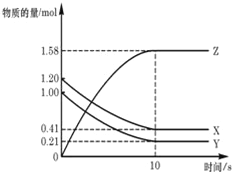
-
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是( )
A. 加热 B. 不用稀硫酸,用98%浓硫酸
C. 滴加少量CuSO4溶液 D. 不用铁片,改用铁粉
难度: 中等查看答案及解析
-
根据以下三个热化学方程式:
2H2S(g)+3O2(g)==2SO2(g)+2H2O(l) ΔH=-Q1 kJ/mol
2H2S(g)+O2(g)==2S(s)+2H2O(l) ΔH=-Q2 kJ/mol;
2H2S(g)+O2(g)==2S(s)+2H2O(g) ΔH=-Q3 kJ/mol。
判断Q1、Q2、Q3三者关系正确的是:( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
难度: 简单查看答案及解析
-
下列实验装置或操作能达到实验目的的是 ( )
A.
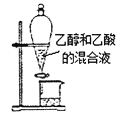 分离乙醇和乙酸 B.
分离乙醇和乙酸 B. 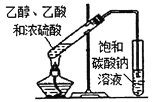 制取乙酸乙酯 C.
制取乙酸乙酯 C. 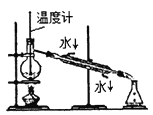 石油的蒸馏 D.
石油的蒸馏 D. 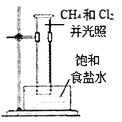 甲烷与氯气反应
甲烷与氯气反应难度: 中等查看答案及解析
-
在2A+B⇌3C+4D反应中,表示该化学反应速率最快的是( )
A. v(A)=0.5mol/(L•s) B. v(B)=0.3mol/(L•s)
C. v(C)=0.8mol/(L•s) D. v(D)=1mol/(L•s)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 化学反应中的能量变化,通常表现为热量的变化
B. 反应物的总能量高于生成物的总能量时发生吸热反应
C. Ba(OH)2•8H2O与NH4Cl的反应是放热反应
D. 木炭在氧气中的燃烧是吸热反应
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA
B. 1.5 mol CH4所含的电子数为15 NA
C. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
D. 常温常压下,11.2 L Cl2含氯原子数为NA
难度: 中等查看答案及解析
-
下列关于化学平衡的说法中,正确的是( )
A. 当达到化学平衡时,反应物已完全转化为生成物
B. 化学平衡是一定条件下的平衡,当条件改变时,平衡可能会遭到破坏
C. 当达到化学平衡时,反应混合物中各成分的浓度相等
D. 当达到化学平衡时,正逆反应均已停止
难度: 中等查看答案及解析
-
下列能用勒夏特列原理解释的是( )
A. 高温及加入催化剂都能使合成氨的反应速率加快
B. 红棕色的NO2加压后颜色先变深后变浅
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. H2、I2、HI平衡时的混合气体加压后颜色变深
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B. 铁与盐酸反应: Fe + 2H+ ══ Fe3+ + H2 ↑
C. 用小苏打治疗胃酸过多: H+ +HCO3-══ H2O + CO2↑
D. Ba(OH)2与稀H2SO4反应: Ba2++OH-+H++SO42-══ BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列反应过程中,△H>0且△S>0的是( )
A. NH3(g)+HCl(g)=NH4Cl(s) B. CaCO3(s)=CaO(s)+CO2(g)
C. 4Al(s)+3O2(g)=2A12O3(s) D. HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)
难度: 中等查看答案及解析
-
一定温度下,可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态标志的是( )
A. A、B、C的分子数之比为1:3:2
B. 单位时间内生成amol N2,同时生成amolNH3
C. 每断裂1molN≡N,同时断裂3molH﹣H
D. 每生成1mol N≡N,同时生成6molN﹣H
难度: 简单查看答案及解析
-
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
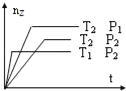
A. T1<T2,P1<P2 B. T1<T2,P1>P2 C. T1>T2,P1>P2 D. T1>T2,P1<P2
难度: 中等查看答案及解析
-
反应:A(气)+3B(气)⇌2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )
A. 正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B. 正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C. 正反应速率和逆反应速率变小,平衡向正反应方向移动
D. 正反应速率和逆反应速率变小,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
已知:Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1kJ•mol﹣1
C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
则2Fe(s)+
O2(g)=Fe2O3(s)的△H是( )
A. ﹣824.4kJ•mol﹣ B. ﹣627.6kJ•mol﹣1 C. +744.7kJ•mol﹣1 D. ﹣169.4kJ•mol﹣1
难度: 中等查看答案及解析
-
在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI⇌H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
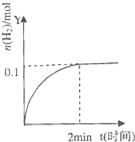
A. 该温度下,反应的平衡常数是
B. 0~2min内的HI的平均反应速率为0.05mol•L﹣1•min﹣1
C. 恒压下向该体系中加入N2,平衡不移动,反应速率不变
D. 升高温度,平衡向正反应方向移动,只有正反应速率加快
难度: 简单查看答案及解析
-
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
CO2(g)+H2(g) △H<0
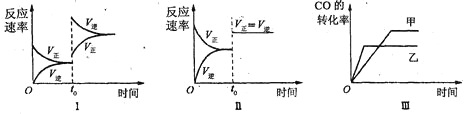
下列分析中正确的是
A、图Ⅱ研究的只是t0时使用催化剂对反应速率的影响
B、图Ⅰ研究的是t0时缩小容器体积对反应速率的影响
C、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
难度: 中等查看答案及解析