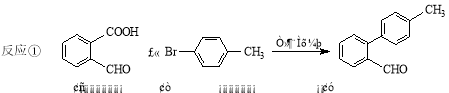
-
化学与社会、生活密切相关。对下列现象或事实的均解释正确的是
选项
现象或事实
解释
A.
在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀
钢铁闸门与锌块在海水中构成原电池,钢铁闸门作正极
B.
某些抗氧化剂作食品添加剂
抗氧化剂与食品反应,延缓食品腐败速率
C.
用热的烧碱溶液洗去油污
Na2CO3可直接与油污反应
D.
明矾可作漂白剂
明矾电离出的Al3+水解时产生具有吸附性的胶体粒子
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A.1L 1 mol•L﹣1的Fe2(SO4)3 溶液加热蒸干得到Fe(OH)3胶体粒子的数目为2NA
B.室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA
C.0.1 L 0.5 mol•L﹣1 CH3COOH溶液中含有的氢离子数目小于0.05NA
D.电解精炼铜时,若阴极得到电子数为2 NA个,则阳极质量减少64 g
难度: 简单查看答案及解析
-
下列实验的反应原理用方程式或电极反应式表示正确的是
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+
B.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
C.用铂做电极,KOH溶液作电解质溶液,甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
D.铅酸蓄电池充电时接直流电源的正极反应:PbSO4+2H2O-2e-= PbO2+4H++SO42-
难度: 中等查看答案及解析
-
可以证明可逆反应N2+3H2⇌2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(N2)=0.2mol•L-1•min-1,v(NH3)=0.4mol•L﹣1•min-1
③保持其他条件不变时,体系压强不再改变;
④恒温恒容时,混合气体的密度保持不变;
⑤NH3、N2、H2的体积分数都不再改变。
A. ①②④ B. ①③⑤ C. ②③④ D.③④⑤
难度: 简单查看答案及解析
-
下列装置或操作能达到实验目的的是
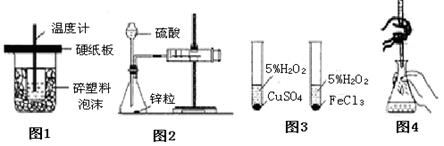
A. 图1装置用于中和热的测定
B. 图2装置用于测定氢气的反应速率(单位mL/s)
C. 图3装置用于研究催化剂Cu2+和Fe3+对反应速率的影响
D. 图4装置用于已知浓度的高锰酸钾溶液测定未知浓度的草酸溶液
难度: 简单查看答案及解析
-
已知水的电离方程式:H2O ⇌ H++OH-。下列叙述中,正确的是
A.向水中加入少量硫酸氢钠溶液,c(H+)增大,KW不变
B.降低温度,KW减小,pH不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量NaClO固体,平衡向逆反应方向移动,c(H+)降低
难度: 简单查看答案及解析
-
下列热化学方程式及有关应用的叙述中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3kJ·mol-1
B.已知强酸与强碱在稀溶液里反应的中和热为57.3 kJ·mol-1, 则1/2 H2SO4(aq)+1/2 Ba(OH)2(aq)= 1/2BaSO4(s)+H2O(l) ΔH= -57.3 kJ·mol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ, 其热化学方程式为:N2(g) + 3H2(g)
2NH3(g) △H= -38.6kJ·mol-1
D.已知25℃、101KPa条件下:4Al(s)+3O2(g)=2A12O3(s) △H=-2834.9 kJ·mol-1,
4Al(s)+2O3(g)=2A12O3(s) △H=-3119.1 kJ·mol-1, 则O2比O3稳定
难度: 简单查看答案及解析
-
下表离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、S2ˉ、Clˉ、Na+
NaOH溶液
Fe3++3OHˉ═Fe(OH)3↓
B
H+、Fe2+、SO42ˉ、NO3ˉ
BaCl 2溶液
SO42ˉ+Ba2+═BaSO4↓
C
Na+、Al3+、Clˉ、SO42ˉ
少量KOH溶液
Al3++3OHˉ═Al(OH)3↓
D
Na+、K+、ClOˉ、SO42ˉ
通入少量SO2
2ClOˉ+SO2+H2O═2HClO+SO32ˉ
难度: 中等查看答案及解析
-
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数数值如下:2NO(g)
N2(g)+O2(g) K1=1×1030 2H2(g)+O2(g)
2H2O(g) K2=2×1081
2CO2(g)
2CO(g)+O2(g) K3=4×10-92 以下说法正确的是
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)/ c(NO)
B.常温下,NO、H2O、CO2三种化合物分解放出O2的进行程度由大到小的顺序为NO>H2O>CO2
C.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
D.以上说法都不正确
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验内容
A
配制氯化铁溶液
将氯化铁溶解在较浓的盐酸中,再加水稀释
B
探究温度对硫代硫酸钠与硫酸反应速率的影响
先将两种溶液混合并计时,再用水浴加热至设定温度
C
证明Ksp(BaSO4)<Ksp(CaSO4)
室温下,向浓度均为0.1 mol·L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀。
D
HSO3-结合H+的能力比SO32-强
室温下,用pH试纸测得:0.1mol·L-1Na2SO3溶液的pH约为10;0.1mol·L-1NaHSO3溶液的pH约为5。
难度: 简单查看答案及解析
-
下列图示与对应的叙述不相符合的是

A.反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0),图I表示总反应过程中能量变化
B.图 II表示反应的化学方程式为3A+B=2C
C.图III表示弱电解质在水中建立电离平衡的过程
D.图IV表示反应M(g)+N(g)⇌ R(g)+2L(?)是放热反应且L是气体
难度: 简单查看答案及解析
-
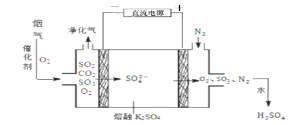
下图是一种航天器能量储存系统原理示意图。
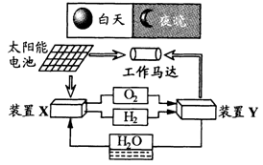
下列说法正确的是
A.该系统中只存在3种形式的能量转化
B.装置X能实现燃料电池的燃料和氧化剂再生
C.装置Y中负极的电极反应式为:O2 + 2H2O + 4e- = 4OH-
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
难度: 简单查看答案及解析
-
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N﹣N吸收167 kJ热量,生成1mol N≡N放出942 kJ。根据以上信息和数据,下列说法正确的是
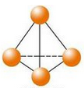
A.N4与N2互为同分异构体
B.1mo1N4气体转变为N2将吸收882kJ热量
C.N4(g)=2N2(g) ΔH = - 882KJ
D.P4(白磷)的分子结构与N4相似,1mol N4和1mol P4均含有6mol非极性键
难度: 简单查看答案及解析
-
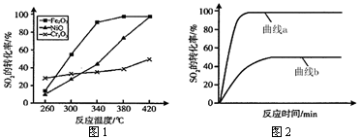
图Ⅰ是NO2(g)+CO(g)
CO2(g)十NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X增大的变化关系曲线如图Ⅱ所示。
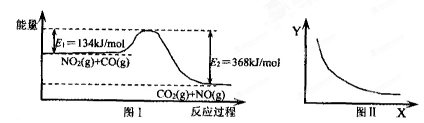
下列有关说法正确的是
A.该反应的焓变△H= +234 kJ·mol-1
B.若X表示温度,则Y表示的可能是CO2的物质的量浓度
C.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
D.若X表示反应时间,则Y表示的可能是混合气体的密度
难度: 简单查看答案及解析
-
爱迪生电池在充电和放电时发生反应:Fe+ NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列该蓄电池推断错误的是
①放电时,电解质溶液中的阴离子向正极方向移动
②放电时,Fe参与负极反应,NiO2参与正极反应
③放电时,负极上的电极反应式为:Fe + 2H2O- 2e- = Fe(OH)2 + 2H+
④充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
⑤蓄电池的电极必须浸入某种碱性电解质溶液中
A.③⑤ B.③④ C. ①③ D.①⑤
难度: 简单查看答案及解析
-
室温下,用相同浓度的NaOH溶液,分别滴定100mL浓度均为0.1mol·L-1的三种酸(HM、HN和HR)溶液,滴定的曲线如图所示,下列判断错误的是

A.三种酸的电离常数关系:KHM>KHN>KHR
B.pH=7时,三种溶液中:c(M-)>c(N-)>c(R-)
C.滴定至P点时,溶液中:c(Na+)> c(N-)>c(HN)>c(H+)>c(OH-)
D.当中和百分数达100%时,将三种溶液混合后:c(HM)+c(HN)+c(HR)=c(OH-)-c(H+)
难度: 简单查看答案及解析