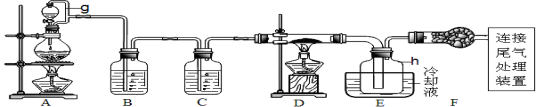
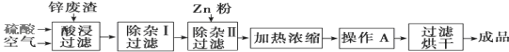
-
下列说法正确的是 ( )
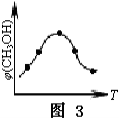
A.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
B.油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应
C.棉花、羊毛、腈纶和涤纶都属于合成纤维
D.用甘氨酸(
)和丙氨酸(
)缩合最多可形成4种二肽
难度: 中等查看答案及解析
-
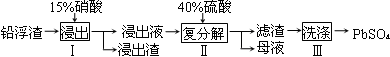
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是 ( )
A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应
D.A、C、D的最高价含氧酸的钠盐水溶液可能均显碱性
难度: 中等查看答案及解析
-
类推思维是化学解题中常用思维方法,下列有关反应方程式的类推正确的是 ( )
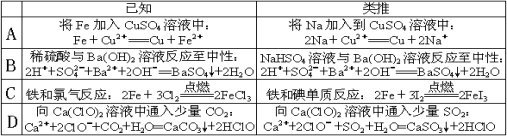
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反应原理为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是 ( )
A.反应中氧化剂是Na2O2,还原剂是FeSO4
B.生成2 mol Na2FeO4时,反应中共有8 mol电子转移
C.Na2FeO4的氧化性大于Na2O2
D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生
难度: 中等查看答案及解析
-
下述实验操作没有错误的是( )

难度: 简单查看答案及解析
-
下列说法中,正确的是 ( )
A.苯、乙醇和乙酸都能发生取代反应
B.CH3CH2CH2CH3的二氯取代产物只有5种结构
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.使用溴的四氯化碳溶液或酸性KMnO4溶液都可以除去乙烷中混有的乙烯
难度: 简单查看答案及解析
-
25℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是 ( )
A.对于该溶液一定存在:pH≥7
B.若c(OH-)>c(H+),则溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
C.若溶液中c(A-)= c(Na+),则溶液一定呈中性
D.若溶质为NaA,则溶液中一定存在:c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为 。
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。
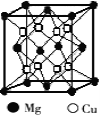
(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO
OHC-CH2CH2OH。
OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
难度: 困难查看答案及解析