-
古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是
A.“冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高
B.“玉不琢不成器”,“百炼方能成钢”发生的均为化学变化
C.“甘之如饴”说明糖类均有甜味
D.“火树银花”中的焰火实质上是金属元素的焰色反应
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,36g18O2中所含的中子数为16NA
B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA
C.电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA
D.标准状况下,2.24LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA
难度: 简单查看答案及解析
-
下列关于乙醇和乙酸的说法错误的是
A.乙醇和乙酸都是常用调味品的主要成分
B.相同条件下,与金属钠反应的速率,乙醇比乙酸慢
C.乙醇可由乙烯与水发生加成反应制得,乙酸可由乙醇氧化制得
D.乙醇和乙酸之间能发生酯化反应,酯化反应的逆反应为皂化反应
难度: 简单查看答案及解析
-
25℃时,用浓度为0.1000mol/L的氢氧化钠溶液分别滴定20. 00mL浓度均为0.l000mol/L 的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是
数据编号
滴入NaOH(aq)的体积/mL
溶液的pH
HX
HY
①
0
3
1
②
a
7
x
③
20.00
>7
y
A.在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B.由表中数据可估算出Ka(HX)≈10-5
C.HY和HX混合,c(H+)=c(X一)+c(Y一)+c(OH一)
D.上述②反应后的HY溶液中:c(Na+)>c(Y一)>c(OH一)>c(H+)
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将SO2通入Ba(NO3)2溶液中
产生白色沉淀
BaSO3难溶于水
B
乙烯通入溴的CCl4溶液中
溶液红棕色褪为无色
乙烯与Br2发生加成反应
C
某化合物在无色酒精灯火焰上灼烧
焰色为黄色
该化合物一定为钠盐
D
向盛少量Mg(OH)2沉淀的试管中加入适量NH4Cl浓溶液,充分振荡
白色固体逐渐溶解
NH4+水解出的H+与Mg(OH)2:电离出的OH-结合导致Mg(OH)2溶解
难度: 中等查看答案及解析
-
五种短周期主族元素X、Y、Z、W、R、X的原子半径是短周期主族元素中最大的,Y元素 的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素与Y元素同主族。下列叙述错误的是
A.60gZY2中含有2molZ-Y极性共价键
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.X与Y形成的两种常见化合物中阴、阳离子的个数比均为1:2
难度: 中等查看答案及解析
-
我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法正确的是
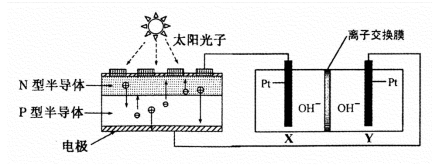
A.图中N型半导体为正极,P型半导体为负极
B.图中离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的碱性增强
D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
难度: 困难查看答案及解析



 ,lkW·h= 3. 6×1 06J) 。
,lkW·h= 3. 6×1 06J) 。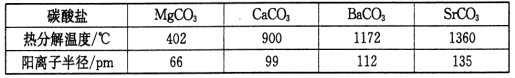

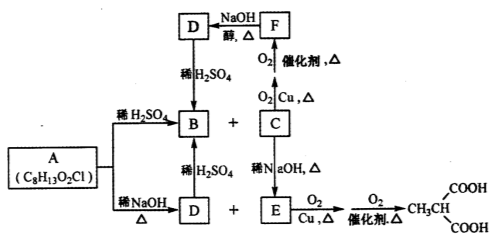
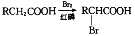 ,请以2一甲基丙醇和甲醇为原料,设计制备有机玻璃(聚甲基丙烯酸甲酯)的合成路线.合成路线流程图示例如下:
,请以2一甲基丙醇和甲醇为原料,设计制备有机玻璃(聚甲基丙烯酸甲酯)的合成路线.合成路线流程图示例如下: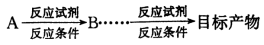 。
。