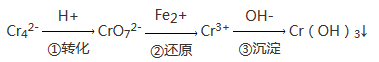-
下列常见原子或基团中,不属于官能团的是( )
A. 羟基 B. 卤原子 C. 烃基 D. 乙烯基
难度: 中等查看答案及解析
-
下列化学用语对应正确的是( )
A. CH4分子的比例模型:
B. 乙酸的化学式:C2H4O2
C. 乙烯的结构简式CH2CH2 D. F-的结构示意图:
难度: 中等查看答案及解析
-
已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )

A. CO的标准燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
将4molA气体和2molB气体在2 L的容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)
2C(g)。若经2 s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1 ;
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1;
③2s时物质A的转化率为30% ;
④2s时物质B的浓度为1.4mol·L-1。
其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A. Al、Cu、稀H2SO4组成原电池,负极反应式为:Al-3eˉ=Al3+
B. Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3eˉ+4OHˉ=AlO2ˉ+2H2O
C. 由Al、Cu、浓硝酸组成原电池,负极反应式为:Cu-2eˉ=Cu2+
D. 由Fe、Cu、FeCl3溶液组成原电池,负极反应式:Cu-2eˉ=Cu2+
难度: 中等查看答案及解析
-
25 ℃时,Ksp[Mg(OH)2] = 5.61×10-12,Ksp(MgF2)= 7.42×10-11。下列说法正确的是( )
A. 25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B. 25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L氨水中的Ksp比在20 mL 0.01 mol/L NH4Cl溶液中的Ksp小
C. 25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大
D. 25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2
难度: 中等查看答案及解析
-
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:( )
A. 该溶液的pH值约为4 B. 此酸的电离平衡常数约为1×10-7
C. 升高温度,溶液pH增大 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
难度: 中等查看答案及解析
-
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )

A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
某温度下,0.01mol/L NaOH的pH为10,该温度下将pH=5的强酸溶液和pH=8的强碱溶液混合后pH=7,则酸溶液体积和碱溶液体积比为( )
A. 1:10 B. 10:1 C. 9:2 D. 2:9
难度: 困难查看答案及解析
-
下列图象能正确地表达可逆反应3A(g)+B(g)
2C(g);△H<0的是( )

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO42-+4H2O
C. 充电时,蓄电池的负极应与外接电源正极相连
D. 放电时负极附近溶液的碱性减弱
难度: 中等查看答案及解析
-
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图。下列说法不正确的是( )
已知:
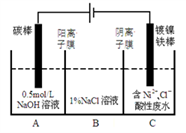
①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH— -4e—==O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式改变
难度: 中等查看答案及解析
-
如下图所示,下列说法正确的是( )

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体
难度: 困难查看答案及解析
-
室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )
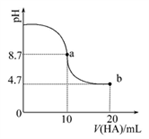
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
难度: 困难查看答案及解析
-
室温下,下列说法中错误的是( )
A. pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B. pH=5的下列溶液(①NH4Cl溶液②CH3COOH溶液;③稀盐酸)中由水电离出来的c(H+)水①>②>③
C. pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
D. pH相同的下列三种溶液(①CH3COONa、②NaHCO3、③NaClO)中的c(Na+):①>②>③
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B. 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. AgCl悬浊液中存在平衡: AgCl(s)
Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
难度: 困难查看答案及解析