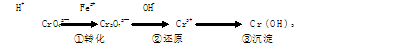-
下列图象中所发生的现象与电子的跃迁无关的是

难度: 简单查看答案及解析
-
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是
A.该反应中旧键断裂需要吸收能量,新键形成需放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
难度: 简单查看答案及解析
-
下列变化中,属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释
④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A.①④ B.②③ C.①④⑤ D.①②④
难度: 简单查看答案及解析
-
仅改变下列一个条件,通过提高活化分子的百分数来提高反应速率的是
A.加热 B.加压 C.降温 D.加大反应物浓度
难度: 简单查看答案及解析
-
在2升的密闭容器中,发生以下反应:2A(g)+B(g)
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A.1.6 mol B.2.8 mol C.2.4 mol D.1.2 mol
难度: 简单查看答案及解析
-
我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+
难度: 简单查看答案及解析
-
关于如图所示装置的叙述正确的是

A.甲、乙装置中的锌片都作负极
B.甲、乙装置中的溶液内的H+在铜片被还原
C.甲、乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片有气泡生成,乙装置中的铜片质量减小
难度: 简单查看答案及解析
-
下列各图所反映的措施中,目的是为了加快其化学反应速率的是

难度: 简单查看答案及解析
-
已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图(Ⅰ)所示:ΔH1=ΔH2+ΔH3根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是

A.A―→F ΔH=-ΔH6
B.A―→D ΔH=ΔH1+ΔH2+ΔH3
C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
D.ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ/mol
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ/mol

下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ/mol
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应CH3OH(l)+O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
难度: 简单查看答案及解析
-
下列关于原电池和电解池的比较中正确的是
A.能量转化形式相同
B.两极的名称相同
C.负极和阴极上移向的离子类别相同
D.负极和阳极上发生的反应类型相同
难度: 简单查看答案及解析
-
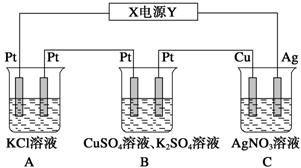
用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的组是
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
难度: 简单查看答案及解析
-
X、Y、Z、M、N代表五种金属。有以下化学反应:
①水溶液中:X+Y2+===X2++Y
②Z+2H2O(冷)===Z(OH)2+H2↑
③M、N为电极与N盐溶液组成原电池,发生的电极反应为:M-2e-===M2+
④Y可以溶于稀H2SO4中,M不被稀H2SO4氧化.
则这五种金属的活泼性由弱到强的顺序是
A.M<N<Y<X<Z B.N<M<X<Y<Z
C.N<M<Y<X<Z D.X<Z<N<M<Y
难度: 简单查看答案及解析
-
下列各基态原子或离子的电子排布式错误的是
A.Al 1s22s22p63s23p1 B.S2- 1s22s22p63s23p4
C.Na+ 1s22s22p6 D.F 1s22s22p5
难度: 简单查看答案及解析
-
已知反应A2(g)+2B2(g)
2AB2(g) ΔH<0,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
难度: 简单查看答案及解析
-
在一定温度不同压强(p1<p2)下,可逆反应2X(g)
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是
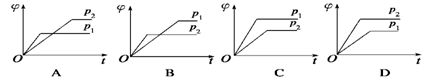
难度: 简单查看答案及解析
-
碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
A.灯管工作时,灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的百分含量越高
C.该反应的平衡常数表达式是K=
D.灯丝附近温度越高, I2(g)的转化率越高
难度: 简单查看答案及解析
-
下列能级中轨道数为3的是
A.S能级 B.P能级 C.d能级 D.f能级
难度: 简单查看答案及解析
-
一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A.+1 B.+2 C.+3 D.-1
难度: 简单查看答案及解析
-
现用pH=3的CH3COOH溶液和pH=11的NaOH溶液各V mL,进行中和滴定,当滴定到pH=7时,锥形瓶内溶液的体积为(滴定前后溶液未稀释、总体积不变)
A.等于2V mL B.小于2V mL
C.大于2V mL D.小于、等于或大于2VmL
难度: 简单查看答案及解析
-
下列基态碳原子最外能层电子排布图正确的是
难度: 简单查看答案及解析
-
某地酸雨中,c(Na+)=7.0×10-6 mol·L-1,c(Cl-)=3.5×10-5 mol ·L-1,
c(NH)=2.3×10-5mol/L,c(SO)=2.5×10-6 mol/L,则该地酸雨的pH为
A.3 B.4 C.5 D.6
难度: 简单查看答案及解析
-
下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol/L的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
难度: 简单查看答案及解析
-
下列关于电解质溶液中离子关系的说法正确的是
A.0.1 mol·L-1NaHCO3溶液中离子浓度关系:
c(Na+)=2c(CO)+c(HCO)+c(H2CO3)
B.0.1 mol/L NH4Cl和0.1 mol·L-1 NH3·H2O等体积混合后离子浓度关系:
c(Cl-)>c(NH)>c(H+)>c(OH-)
C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:
c(Na+)=c(CH3COO-)
D.常温下,在pH=1的溶液中,Fe2+、NO、ClO-、Na+能大量共存
难度: 简单查看答案及解析
-
V下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO、NO
B.c(H+)=1×10-1 mol/L的溶液中:Cu2+、Al3+、SO、NO
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH、S2-、Br-
D.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO
难度: 简单查看答案及解析